Les médecins désignent souvent des malformations comme la trisomie 18 ou l'anencéphalie comme « létales » ou « incompatibles avec la vie ». Dès le diagnostic, cela les conduit à favoriser l'interruption de la grossesse, souvent considérée comme la seule possibilité, et à laquelle les parents sont souvent encouragés avec des informations imprécises et partielles. De plus, en cas de choix de poursuite de la grossesse, les médecins écartent d'emblée les soins médicaux néonatals, considérés comme « futiles », au profit des soins palliatifs, voire d'un refus de dispenser des soins au nouveau-né.
Cependant, il faut savoir que les médecins eux-mêmes divergent sur la définition des malformations létales : s'agit-il de celles qui ont plus de 50% de chances d'aboutir au décès prématuré de l'enfant? Ou faut-il plutôt parler de 75 %, 90%, 95% voire 99% de décès néonatals ? De même, il n'y a aucun consensus sur les pathologies qu'il faudrait y inclure, au point qu'aucune d'entre elles ne se retrouve sur toutes les listes. Enfin, même si la survie prolongée des nouveaux-nés atteints des malformations les plus souvent caractérisées comme mortelles est rare, elle est possible et attestée par plusieurs cas (allant de 10 mois à 2.5 ans de vie en ce qui concerne l'anencéphalie, et jusqu'à 50 ans pour la trisomie 18 ; et ces chiffres seraient plus favorables si l'écrasante majorité de ces grossesses n'était pas interrompue, souvent à cause d'informations inexactes voire déloyales).
Ainsi, il y a un contraste flagrant entre l'incertitude scientifique et la complexité de la réalité d'une part, et la systématicité des recommandations médicales d'autre part, souvent catégoriques et radicales, et du moins bien plus affirmatives que l'état des connaissances ne devrait le permettre. Plutôt que de malformations « létales » ou « incompatibles avec la vie », les médecins devraient plutôt parler de conditions « limitant la vie » (en mettant l'accent sur les risques de déficience et leur probabilité), de malformations avec un « pronostic défavorable » ou de malformations « potentiellement mortelles », en se gardant bien de porter un jugement sur la valeur ou la qualité de la vie. Cela permettrait aux parents de faire un choix plus éclairé en ce qui concerne la poursuite de la grossesse et la perspective de la prise en charge à la naissance, des soins actifs pouvant parfois se révéler appropriés.
Langage éthique et prise de décision pour les malformations létales diagnostiquées avant la naissance
Par Dominic Wilkinson*, Lachlan de Crespigny**, et Vicki Xafisc***
Séminaires en médecine fœtale et néonatale, octobre 2014
Traduction : anencephaly.info
* Médecin spécialisé dans les soins intensifs néonatals et l’éthique médicale. Professeur d’éthique médicale au Directeur du département d’éthique médicale du Centre Uehiro pour l’éthique pragmatique de l’Université d’Oxford ; Néonatologue consultant à l’hôpital John Radcliffe ; Directeur de recherche à Jésus College (Université de Cambridge).
** Médecin obstétricien et gynécologue échographiste à Carlton, Victoria (Australie), spécialisé dans le diagnostic prénatal ; Professeur au Département d’obstétrique et de gynécologie, Université de Melbourne, Australie.
*** Professeur au Département d’obstétrique et de gynécologie de l’Institut Robinson, Université d’Adélaïde, Australie.
Résumé
Dans la pratique clinique et dans la littérature médicale, les malformations congénitales sévères telles que la trisomie 18, l’anencéphalie et l’agénésie rénale sont fréquemment appelées « létales » ou « incompatibles avec la vie ». Cependant, il n’y a pas d’accord sur une définition des malformations létales, ni sur les pathologies à inclure dans cette catégorie. L’examen des résultats des malformations communément appelées « létales » ou « mortelles » révèle qu’une survie prolongée est possible, même si elle est rare. Cet article analyse le concept de malformations létales et le compare au concept problématique de « futilité » des soins médicaux. Nous recommandons d’éviter le terme « létal » et suggérons que le conseil médical se concentre plutôt sur les caractéristiques pronostiques saillantes. Pour les pathologies avec un risque élevé de décès précoce ou de déficience profonde chez les survivants malgré le traitement, les soins palliatifs périnatals et néonatals seraient un choix éthique. Cependant, une prise en charge obstétricale et néonatale active, si elle est souhaitée, peut également être appropriée dans certains cas.
Mots-clés : nourrisson, nouveau-né, issue fatale, éthique, futilité des soins médicaux, trisomie, interruption de grossesse (terminaison fœtale).
1. Introduction
Le dépistage prénatal, en particulier le recours à un dépistage échographique de routine au milieu du premier trimestre, a modifié le diagnostic des malformations congénitales majeures. En conséquence, dans de nombreuses régions du monde, il est désormais rare de découvrir des malformations majeures à la naissance [1]. Le diagnostic prénatal permet potentiellement des tests diagnostiques ciblés, la planification de l’accouchement, le conseil et l’éducation des couples, et une intervention postnatale précoce pour les nouveau-nés atteints de malformations congénitales [2]. Cependant, le diagnostic prénatal peut identifier des anomalies graves pour lesquelles un traitement n’est pas disponible, ou peu susceptible de réussir, et où la mort fœtale ou néonatale est une issue probable. Ces cas sont souvent appelés « malformations létales ».

Encadré 1
On considère souvent que le diagnostic de malformation létale a des implications éthiques et juridiques pour la prise en charge pendant la grossesse, l’accouchement et la période postnatale [3-6]. Par exemple, il peut permettre une prise en charge obstétricale axée sur le bien-être maternel plutôt que sur la survie fœtale, l’interruption de grossesse (y compris en fin de grossesse) ou la non-réanimation à la naissance [7]. Mais que voulons-nous dire lorsque nous caractérisons une malformation comme « létale » ? Quelles conditions entrent dans cette catégorie ? Quelles sont les implications éthiques du diagnostic de malformation létale ?
2. Le concept de « malformation létale »
Le mot « mortel » est dérivé du latin « letalis » (mortel), et lié à un mot grec signifiant « oubli », se référant au mythe selon lequel les âmes des morts oublient leur vie sur Terre après avoir bu les eaux du fleuve Léthé. Conventionnellement, « létal » est utilisé pour décrire quelque chose (par exemple une action ou un agent) qui causera la mort [8].
En théorie, il existe plusieurs façons d’interpréter la description d’une malformation comme létale (Encadré 2).

Agrandissement : Illustration 2

Encadré 2
Une revue de la littérature existante sur les malformations mortelles n’a révélé aucun consensus sur laquelle de ces définitions doit être appliquée [9]. La première définition ne s’applique à aucune des malformations mortelles couramment citées et ne figure pas dans la littérature. La deuxième définition est probablement la plus plausible et la plus fréquemment rencontrée [5, 10-13]. Chervenak et McCullough approuvent cette définition : « une condition létale bien comprise entraîne invariablement la mort, c’est-à-dire qu’il n’y a pas de traitement efficace qui empêchera une condition, une maladie ou une blessure de provoquer la mort dans un avenir proche » [14]. Cependant, cette définition ne s’applique à aucune des malformations souvent décrites comme létales. Certaines publications ont utilisé la troisième définition [15-18]. Cela soulève une question sur le niveau de risque de décès suffisant pour entrer dans une catégorie mortelle. La proportion citée va de 50% à « presque tous » [16, 19]. Il n’y a ni accord sur la proportion correcte, ni aucune manière évidente de déterminer où doit se situer la limite. La quatrième définition est utilisée dans certaines études épidémiologiques sur la mortalité néonatale [20-22]. Cependant, elle semble beaucoup trop large pour correspondre à la façon dont le concept de malformation létale est utilisé par les obstétriciens et les néonatologistes.
3. Quelles malformations sont mortelles ?
Bien que l’Encadré 1 répertorie les malformations mortelles les plus fréquemment citées, plus de 25 conditions sont incluses dans différentes listes [9]. Aucune condition n’était présente sur toutes les listes, et les variations étaient considérables.
Quel est le résultat de ces malformations ? Le Tableau 1 présente une tentative d’estimation des résultats ; cependant, les valeurs citées sont nécessairement imprécises. Des proportions élevées de grossesses affectées sont interrompues [47]. Étant donné que ces conditions sont associées à un taux de mortalité fœtale élevé, le taux de survie varie également avec l’âge gestationnel au moment du diagnostic. La survie postnatale est également difficile à estimer en raison du biais de sélection dans les cohortes publiées et du problème des prophéties auto-réalisatrices [48, 49]. Lorsqu’une grande proportion de nourrissons reçoivent des soins palliatifs après la naissance, un taux de mortalité élevé est inévitable [9].
Agrandissement : Illustration 3
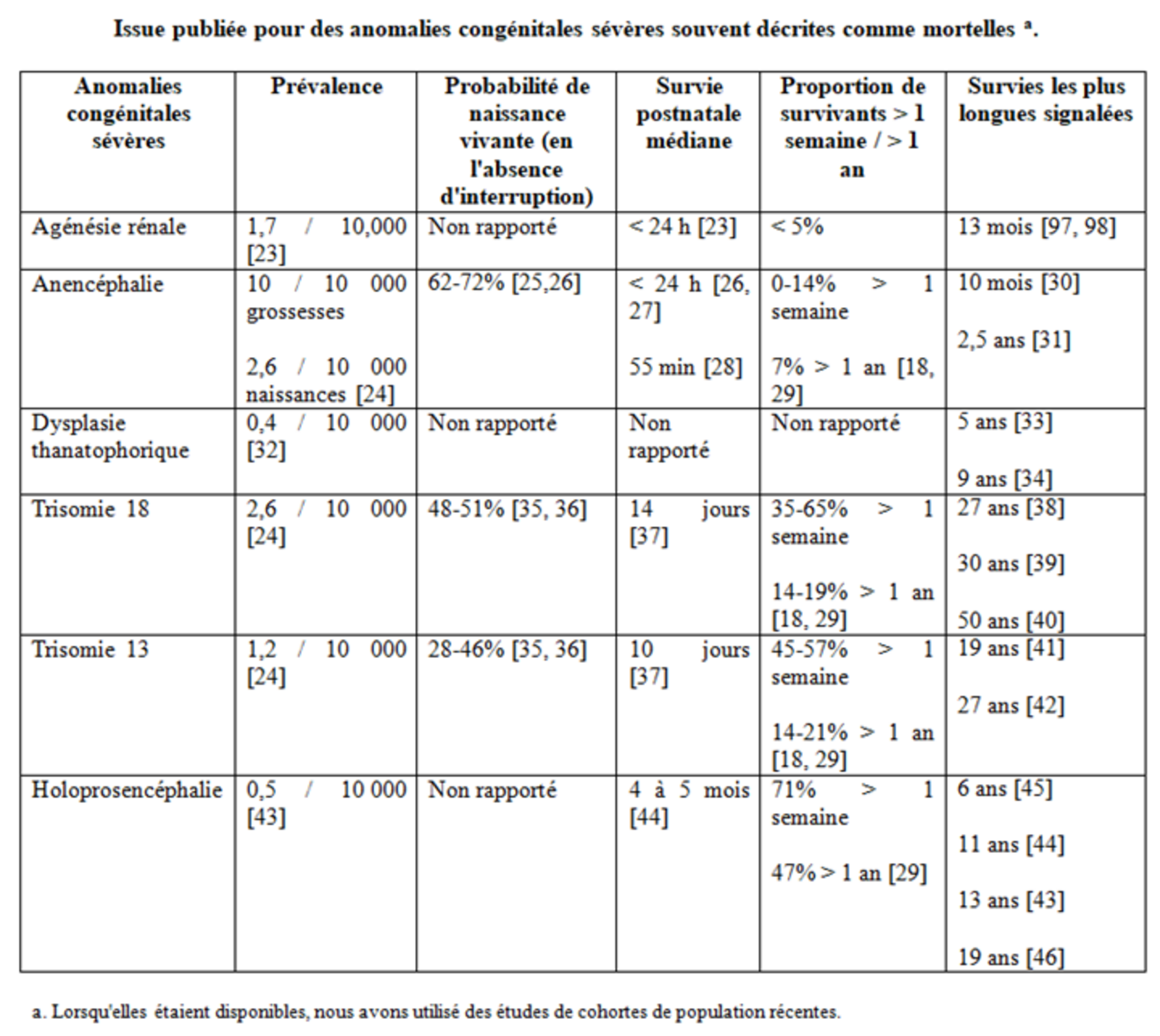
Tableau 1
Ce qui ressort clairement du Tableau 1, c’est qu’une survie d’au moins six mois a été décrite dans toutes les conditions fréquemment citées comme létales. Plus frappant, cela comprend à la fois l’anencéphalie et l’agénésie rénale bilatérale. Aux États-Unis, un cas de nourrisson atteint du syndrome de Potter, traité par amnio-perfusion prénatale et dialyse rénale néonatale, a récemment été publié : il a survécu pour être inscrit à la transplantation rénale à l’âge d’un an.
4. L’importance d’un « diagnostic létal »: les exemples des trisomie 18 et 13
Les trisomies autosomiques sévères 18 (syndrome d’Edwards ; T18) et 13 (syndrome de Patau ; T13), sont souvent décrites comme létales [18, 50-53]. Pourtant, de récentes études de cohortes de population montrent que plus de la moitié des enfants nés vivants atteints de ces affections survivent plus d’une semaine et jusqu’à 20% survivent plus d’un an [18, 29]. Dans une grande série américaine comprenant 52 262 nourrissons de très faible poids à la naissance, 11% des nourrissons atteints de T13 et 9% des nourrissons atteints de T18 ont survécu jusqu’à pouvoir quitter l’hôpital [54]. Il est possible que même ces valeurs représentent une sous-estimation des taux de survie potentiels, car dans certaines régions du monde où la chirurgie cardiaque est proposée aux nourrissons atteints de T13 ou T18, des taux de survie à un an atteignant 50% ont été signalés [55].
Pourquoi le fait que ces conditions sont décrites comme létales est-il important ? La première raison de s’inquiéter de cette terminologie est son potentiel de malentendu et de mauvaise communication. Nous avons interrogé plus de 1 000 obstétriciens du Royaume-Uni, d’Australie et de Nouvelle-Zélande sur la prise en charge périnatale du T18 [56]. L’écrasante majorité (85%) des obstétriciens considéraient le T18 comme une malformation létale. Plus de 50% considéraient le T18 comme « incompatible avec la vie ». Nous n’avons pas demandé aux obstétriciens s’ils utiliseraient ces termes dans le conseil, mais une enquête auprès des parents des groupes de soutien T13 / T18 a révélé que 93% avaient été informés par des professionnels de la santé que l’état de leur enfant était « mortel ou incompatible avec la vie » [57]. Cela contraste avec les preuves résumées ci-dessus et avec la propre compréhension des obstétriciens quant à la notion de survie. Les trois quarts des répondants ont estimé qu’au moins 5% des nourrissons affectés survivraient pendant plus d’un an si un traitement était fourni [56].
Les études qualitatives et les récits des parents de nourrissons atteints de T13 ou T18 décrivent des sentiments de colère et de désillusion et un sentiment d’avoir été induits en erreur par les professionnels de la santé ainsi que par le langage utilisé [58-61]. De nombreux parents ont indiqué que les prestataires de soins de santé n’avaient pas été en mesure d’aller au-delà des statistiques défavorables [57]. De plus, Internet a donné aux familles la possibilité de faire leurs propres recherches et de rencontrer d’autres perspectives sur l’état de leur enfant. Après quelques secondes de recherche « trisomie 18 », un parent peut voir des photos de nombreux enfants plus âgés atteints de trisomie 18, souriants et heureux, des preuves solides contre « l’incompatibilité avec la vie ». Si leur médecin leur a dit que la trisomie 18 est toujours mortelle, cela peut avoir des répercussions permanentes sur la capacité de la famille à faire confiance aux professionnels de la santé [44].
Agrandissement : Illustration 4
Une autre raison de s’inquiéter de la désignation d’une condition telle que T18 comme « mortelle » est due au fait que ce langage contient des jugements de valeur cachés sur la qualité de vie des nourrissons survivants [31,49]. Quatre-vingt pour cent des obstétriciens de notre enquête pensaient que le T18 n’était pas compatible avec une « vie significative » [56]. Classifier une condition comme « létale » peut également confisquer la prise de décisions des parents [31, 49]. Dans notre enquête, 23% des obstétriciens ne discuteraient ni n’offriraient de surveillance fœtale pendant le travail pour les femmes après un diagnostic prénatal de T18, et 28% n’offriraient jamais de césarienne pour détresse fœtale [56]. Dans l’étude du groupe de soutien aux parents, les deux tiers des parents ont déclaré avoir ressenti une pression pour mettre fin à leur grossesse [57].
Il existe un concept en éthique médicale qui partage certaines caractéristiques avec celui de malformation létale : le concept de « futilité médicale » [9, 19]. La notion de futilité médicale est apparue dans les années 1990 comme un moyen potentiel de résoudre les différends entre les patients et les médecins au sujet du traitement de survie [62]. Elle reflétait le besoin perçu par les professionnels de la santé de limiter l’autonomie des patients et de justifier une décision de ne pas dispenser le traitement demandé [62]. L’idée de base était que même s’il était important de respecter l’opinion des patients sur le traitement, les professionnels de la santé n’étaient pas obligés de fournir un traitement futile [63]. Cependant, le concept de futilité est tombé en disgrâce en raison d’un certain nombre de problèmes graves en parallèle avec le concept de malformation létale [64, 65].
Premièrement, il y a un problème avec la définition de la futilité. Il y a eu au moins cinq définitions différentes proposées et aucun accord sur celle qui devait être utilisée [64]. Certains auteurs distinguent la futilité quantitative de la futilité qualitative [63]. Un traitement est quantitativement inutile s’il a très peu de chances de succès. Cependant, tout comme pour la troisième définition de malformation létale, il est difficile de déterminer où le seuil statistique doit se situer. Un risque de décès de 90% est-il suffisamment élevé, ou devrait-il être de 95% ou 99% ? La trisomie 13/18 peut sembler mortelle d’après certaines définitions, mais pas pour d’autres.
Deuxièmement, même si un seuil statistique particulier est utilisé, il est difficile de déterminer si un traitement serait réellement inutile dans un cas individuel. Même si le traitement n’a pas réussi dans le passé, il peut y avoir eu des changements technologiques qui pourraient potentiellement améliorer la survie. Il peut y avoir des caractéristiques spécifiques pour un patient individuel qui le distinguent des cohortes agrégées. (Par exemple, un fœtus avec T18 peut avoir un cœur structurellement normal et sembler avoir un meilleur pronostic, ou peut avoir un cœur gauche hypoplasique et avoir un pronostic bien pire que la moyenne [66].) Souvent, les données existantes sur lesquelles on pourrait baser un pronostic sont limitées. Le problème des prophéties auto-réalisatrices signifie que les données disponibles peuvent ne pas être représentatives des chances réelles de survie si un traitement était fourni [48].
Troisièmement, la définition la plus claire et la plus stricte disponible semble exclure presque tous les cas réels. Le traitement serait « physiologiquement vain » s’il n’y avait aucun moyen d’atteindre son objectif physiologique [62]. Par exemple, la réanimation cardio-pulmonaire serait physiologiquement futile si elle n’avait littéralement pas la capacité de rétablir la circulation et la respiration. De façon analogue, une condition peut être considérée comme mortelle (selon la deuxième définition) si la survie est impossible quel que soit le traitement. Cependant, l’une ou l’autre de ces définitions ne semble rendre le concept pertinent que dans des cas extrêmement rares, et certainement pas pour T13 ou T18.
Quatrièmement, on craint que le terme « futile », en particulier lorsqu’il est utilisé qualitativement, revienne à « donner une opinion déguisée en données » [67]. Les traitements sont décrits comme « qualitativement futiles » lorsque le traitement peut être capable de maintenir la vie mais n’est pas perçu comme bénéfique pour le patient. Par exemple, la prestation de soins intensifs à un patient dans un état végétatif persistant a été décrite comme étant qualitativement futile [63]. De même, certaines définitions de la malformation létale incluent des conditions associées à un état végétatif persistant ou à un développement cognitif absent [6, 10, 68, 69]. Dans notre enquête auprès des obstétriciens, 20% ont indiqué que le meilleur résultat de développement dans T18 est un état végétatif [56]. Pourtant, les données disponibles suggèrent que les enfants atteints de T18 et T13, bien que généralement profondément handicapés, ne sont pas végétatifs. Les enfants survivants seraient conscients de ceux qui les entourent, entendraient et répondraient au son, et apprendraient et se souviendraient [39]. La plupart sont incapables de parler, mais sont capables de communiquer de manière non verbale à un niveau basique [70]. Que ce niveau de fonction soit suffisant ou pas pour l’emporter sur le fardeau du traitement constitue une question éthique importante. Il peut ou non être dans l’intérêt supérieur d’un enfant de lui fournir un traitement particulier compte tenu de ce pronostic [52, 68, 71]. Cependant, il est clair que cela implique un jugement sur la valeur de la vie dans un état cognitif gravement handicapé. Les directives professionnelles approuvent fortement l’idée que le conseil après le diagnostic prénatal devrait être non directif et neutre en valeur [72-74]. Alors que certains auteurs se sont demandé si une neutralité complète dans le conseil est possible ou souhaitable [72, 75-77], il y a de bonnes raisons pour les médecins d’aspirer à la neutralité dans la plupart des circonstances. Un moyen important de le faire est d’éviter le langage qui contient des jugements de valeur implicites [78].
5. Au-delà du concept de « malformations létales »
Nous avons critiqué le concept de malformation létale, mais qu’est-ce que cela signifie pour le conseil ou pour la prise de décision ?
Il pourrait être possible de trouver un autre terme pour décrire toutes les affections congénitales qui sont généralement appelées létales. Elles semblent partager un risque élevé de décès et de déficience profonde quelle que soit la tentative de traitement. Nous pourrions parler de conditions « limitant la vie » [79], de malformations avec un « pronostic défavorable » ou de malformations « potentiellement mortelles » [79]. Cependant, tout nouveau terme aura les mêmes problèmes de définition de la probabilité et de la gravité d’une issue fatale qui justifieraient son application. À moins que ce soit une formule que les parents comprennent facilement et de manière fiable, elle devra être expliquée. Au lieu de cela, nous avons précédemment suggéré qu’il serait préférable que le conseil aborde ouvertement et honnêtement les questions pronostiques clés que les parents sont susceptibles de poser après le diagnostic d’une malformation congénitale sévère [9].
- Diagnostic : quel est le diagnostic et à quel point les praticiens peuvent-ils en être certains ?
- Survie néonatale : quelles sont les chances de survie après la période néonatale si des traitements (y compris des thérapies intensives prolongeant la vie) sont fournis ?
- Survie à long terme : combien de temps l’enfant est-il susceptible de survivre si un traitement de survie est apporté ?
- Déficience et maladie à long terme : si le nouveau-né survit, quels problèmes de santé et déficiences à long terme est-il susceptible de connaître ? Quelle est la gamme d’issues possibles ?
- Fardeau du traitement : quels traitements seraient nécessaires pour maintenir le nouveau-né en vie, et quelle serait la charge pour l’enfant et la famille ?
La question éthique la plus importante est de savoir quel traitement doit être proposé ou dispensé aux femmes et aux fœtus et bébés en cas de malformations congénitales graves avec un risque très élevé de décès ou d’incapacité profonde malgré le traitement. Nous avons soutenu que de telles malformations ne devaient pas être qualifiées de « létales ». Cependant, l’étiquette ne doit pas modifier le traitement fourni. L’étiquette que nous donnons aux conditions n’est pas éthiquement pertinente pour énoncer et mettre en œuvre les options appropriées. Un avantage supplémentaire d’éviter la désignation de « létale » peut être que ces conditions ne sont pas identiques. Si nous traitons chaque condition (et donc chaque enfant) selon ses mérites, les options peuvent être appropriées dans certaines circonstances et pas dans d’autres.
Quelles options devraient alors être proposées en cas de malformations graves telles que celles de l’Encadré 1 ? Pour toutes, l’option de soins palliatifs à la naissance doit être donnée aux parents. Le risque élevé de décès ou de déficience profonde signifie qu’il n’est pas sûr que la réanimation et le traitement prolongeant la vie soient dans l’intérêt supérieur de l’enfant [80]. Il est essentiel que des soins palliatifs de haute qualité soient disponibles pour le nourrisson et sa famille [4, 81]. Il est cependant important de s’assurer que les parents et les futurs parents soient conscients du fait que la durée de survie est variable. La prestation de soins palliatifs ne signifie pas nécessairement que l’enfant mourra rapidement [82]. Le soutien palliatif n’a pas besoin d’être limité à la période postnatale, et il peut y avoir des avantages considérables pour la famille en offrant une approche palliative du moment du diagnostic jusqu’à l’accouchement et au-delà [3, 83, 84]. Des programmes de soins palliatifs périnatals sont disponibles dans un nombre croissant de centres. Une approche palliative (axée sur la mère) des soins obstétricaux peut signifier qu’il convient d’éviter le monitoring pendant le travail et de viser un accouchement vaginal, si cela est conforme aux souhaits d’une femme [6, 85-87].
Si les soins palliatifs sont une option, qu’en est-il du contraire ? La réanimation et les soins intensifs devraient-ils être une option ? La prise en charge obstétricale fœtale devrait-elle être disponible ? Ici, une réponse nuancée est nécessaire, qui prenne en compte les spécificités de chaque cas. Néanmoins, nous soutenons la recommandation selon laquelle une approche active de la prise en charge obstétricale, y compris la surveillance fœtale, la césarienne et la réanimation, pourrait être appropriée même face à un taux de mortalité élevé [14, 85, 88, 89]. Un tel traitement n’est pas contraire à l’intérêt de l’enfant [89]. Pour certains parents, la possibilité de passer du temps avec leur enfant alors qu’il est encore en vie peut être extrêmement importante [88]. D’un autre côté, cela ne signifie pas qu’un traitement illimité devrait être mis à la disposition des parents [90]. Un traitement invasif et intensif, en particulier s’il est prolongé, peut ne pas être dans l’intérêt de l’enfant face à de très faibles chances de bénéfice. Un tel traitement peut également être déraisonnable dans le cadre de ressources de santé publique limitées [62]. Les professionnels de la santé peuvent refuser à juste titre un traitement dans de telles circonstances. Toutefois, ces décisions doivent être prises sur la base de la situation spécifique de l’enfant et sur des principes éthiques appliqués de manière cohérente et transparente plutôt que sur la base d’un label de « létalité ».
Qu’en est-il de l’interruption médicale de grossesse (IMG) ? Le diagnostic de malformation létale ne ferait aucune différence pour les décisions concernant l’IMG dans les juridictions qui ne permettent pas l’avortement pour des raisons fœtales, ou qui permettent l’accès à l’IMG pour un large éventail d’anomalies fœtales. Cependant, dans certaines juridictions, le diagnostic d’une malformation « létale » peut permettre l’interruption de grossesse, même à un âge gestationnel où cela serait autrement interdit [91]. Par exemple, le Code de Santé et de Sécurité du Texas [92] fait une exception à l’interdiction de l’interruption de grossesse après 20 semaines si « le fœtus a une anomalie grave et irréversible », définie comme « une condition physique mortelle qui […] quelle que soit la dispensation de traitement médical salvateur, est incompatible avec la vie en dehors de l’utérus » [93]. De même, le Code Pénal colombien autorise l’avortement « en cas de malformations graves du fœtus qui le rendent non viable, certifiées par un médecin » [94]. Les termes « non viable » et « incompatible avec la vie » semblent se rapporter aux malformations létales, et pourraient avoir été destinés à faire référence aux conditions énumérées dans l’Encadré 1. Pourtant, l’analyse indique que l’anencéphalie et même l’agénésie rénale bilatérale sont potentiellement compatibles avec une survie à long terme et sont « viables » selon des définitions strictes. Si tel est le cas, les femmes portant des fœtus atteints de malformation létale pourraient ne pas être en mesure d’accéder à l’avortement.
Il n’entre pas dans le cadre de cet article de fournir une discussion détaillée de l’approche légale ou éthique de la loi sur l’avortement. Néanmoins, nous n’avons pas l’intention de limiter les options des femmes. Pour les juridictions qui considèrent les malformations létales comme un cas spécial et souhaitent autoriser l’avortement dans de tels cas, il y a peut-être trois possibilités.
Une possibilité serait que les législateurs créent des exceptions spécifiques pour des conditions telles que celles énumérées ci-dessus. Par exemple, la Cour suprême du Brésil a jugé que l’avortement est autorisé après le diagnostic d’anencéphalie (mais pas dans d’autres situations) [95]. D’autres conditions pourraient être ajoutées à cette liste, bien qu’en pratique il puisse y avoir des obstacles importants à la réalisation d’un tel changement de loi.
Une deuxième possibilité consisterait à laisser aux professionnels de la santé le soin de décider quelles conditions sont suffisamment sévères pour être considérées en droit comme « létales » ou non viables. La Cour constitutionnelle colombienne a statué que « les décisions doivent être prises par des médecins agissant dans le respect des normes éthiques de leur profession » [94]. Cependant, l’absence de consensus médical sur les conditions qui peuvent et doivent être considérées comme « létales » pourrait conduire à des décisions et à des prises de décision incohérentes [85,96].
Une troisième possibilité consisterait à rédiger une législation définissant les conditions préalables éthiques spécifiques pour autoriser l’interruption de grossesse. Par exemple, Chervenak et McCullough ont soutenu que l’interruption de grossesse devrait être autorisée au cours du troisième trimestre pour les conditions avec un degré élevé de certitude de diagnostic et « une très forte probabilité de décès ou de survie avec un déficit sévère et irréversible de la capacité de développement cognitif » [7, 14]. Il semblerait que cela inclue toutes les conditions de l’Encadré 1.
6. Conclusions
Dans cette revue, nous avons analysé et critiqué le concept de malformations congénitales « létales ». Le terme est trompeur et conduit potentiellement à une mauvaise communication avec les familles et à une prise de décision incohérente. Aucune des malformations fréquemment décrites comme « létales » ne correspond à des définitions strictes de ce terme. Cependant, même si elles ne sont pas mortelles, la gravité de conditions telles que l’anencéphalie, l’agénésie rénale et la T13 / T18 signifie que les soins palliatifs périnataux, les soins obstétricaux centrés sur la mère et potentiellement l’interruption de grossesse sont justifiés. Il peut également être approprié de fournir des soins obstétriques axés sur le fœtus et certains traitements de maintien de la vie pour ces conditions lorsque cela est conforme aux souhaits de la femme et à l’intérêt supérieur de l’enfant.
Points de pratique
- La survie au-delà de la période néonatale a été décrite dans toutes les malformations congénitales qui sont souvent décrites comme « létales ».
- Les termes « malformation létale » ou « incompatible avec la vie » doivent être évités dans le conseil.
- Une approche palliative de la prise en charge pendant la grossesse, l’accouchement et la période postnatale peut être éthiquement appropriée pour les fœtus dont le pronostic est très mauvais.
- Une approche active des soins obstétricaux et néonatals peut également être appropriée dans ces conditions pour permettre aux parents de passer du temps avec leur enfant de son vivant.
Orientations de recherche
- Des recherches sont nécessaires sur la réponse des parents au langage et aux approches de conseil après le diagnostic de malformations congénitales sévères.
- Il existe peu de données sur la fréquence à laquelle les parents choisiraient des approches de soins actives ou palliatives après le diagnostic de malformations congénitales graves.
- Il est nécessaire d’évaluer l’impact des décisions prénatales et postnatales sur le bien-être à long terme des parents.
Déclaration de conflit d’intérêts
Aucun déclaré.
Sources de financement
Ce travail a été soutenu par une subvention du Wellcome Trust [086041/ Z/08/Z]. Dominic Wilkinson a également été soutenu pour ce travail par une bourse de début de carrière de l’Australian National Health and Medical Research Council [1016641].
Remerciements
Nous tenons à remercier le Dr Andrew Watkins et Mme Pauline Thiele pour leurs contributions aux travaux antérieurs liés à ce document.
Voir également :
Anencéphalie : 20 raisons d'y réfléchir à deux fois avant d'interrompre une grossesse
Site internet principal : https://www.anencephaly.info/fr/index.php
Témoignages de parents ayant donné naissance à un enfant atteint d'anencéphalie : https://www.anencephaly.info/fr/temoignages.php
Contact : webmaster@anencephalie-info.org
Références
- Richards D.S., Prenatal ultrasound to detect fetal anomalies. NeoReviews. 2012;13:c9–19. [Google Scholar]
- Lakhoo K. Fetal counselling for surgical conditions. Early Hum Dev. 2012;88:9–13. [PubMed] [Google Scholar]
- Bhatia J. Palliative care in the fetus and newborn. J Perinatol. 2006;26(Suppl. 1):S24–S26. discussion S31–3. [PubMed] [Google Scholar]
- Breeze A.C.G., Lees C.C., Kumar A., Missfelder-Lobos H.H., Murdoch E.M. Palliative care for prenatally diagnosed lethal fetal abnormality. Archs Dis Childh Fetal Neonatal Ed. 2007;92:F56–F58. [PMC free article] [PubMed] [Google Scholar]
- Catlin A., Carter B. Creation of a neonatal end-of-life palliative care protocol. J Perinatol. 2002;22:184–195. [PubMed] [Google Scholar]
- Chervenak F.A., McCullough L.B. An ethically justified, clinically comprehensive management strategy for third-trimester pregnancies complicated by fetal anomalies. Obstet Gynecol. 1990;75(3 Pt 1):311–316. [PubMed] [Google Scholar]
- Chervenak F.A., Farley M.A., Walters L., Hobbins J.C., Mahoney M.J. When is termination of pregnancy during the third trimester morally justifiable? N Engl J Med. 1984;310:501–504. [PubMed] [Google Scholar]
- Oxford English Dictionary online. Oxford University Press; 1989. http://www.oed.com/[Google Scholar]
- Wilkinson D.J.C., Thiele P., Watkins A., De Crespigny L. Fatally flawed? A review and ethical analysis of lethal congenital malformations. Br J Obstet Gynaecol. 2012;119:1302–1307. [PubMed] [Google Scholar]
- World Health Organization. Basic newborn resuscitation: a practical guide. WHO reference number: WQ 450 98BA 1998 [available at: http://www.who.int/maternal_child_adolescent/documents/who_rht_msm_981/en/].
- Hunfeld J.A.M., Wladimiroff J.W., Passchier J., Uniken Venema-Van Uden M., Frets P.G., Verhage F. Emotional reactions in women in late pregnancy (24 weeks or longer) following the ultrasound diagnosis of a severe or lethal fetal malformation. Prenat Diagn. 1993;13:603–612. [PubMed] [Google Scholar]
- Schechtman K.B., Gray D.L., Baty J.D., Rothman S.M. Decision-making for termination of pregnancies with fetal anomalies: analysis of 53,000 pregnancies. Obstet Gynecol. 2002;99:216–222. [PubMed] [Google Scholar]
- Munson D., Leuthner S.R. Palliative care for the family carrying a fetus with a life-limiting diagnosis. Pediatric Clin North Am. 2007;54:787–798. [PubMed] [Google Scholar]
- Chervenak F., McCullough L.B. Responsibly counselling women about the clinical management of pregnancies complicated by severe fetal anomalies. J Med Ethics. 2012;38:397–398. [PubMed] [Google Scholar]
- Courtwright A.M., Laughon M.M., Doron M.W. Length of life and treatment intensity in infants diagnosed prenatally or postnatally with congenital anomalies considered to be lethal. J Perinatol. 2011;31:387–391. [PubMed] [Google Scholar]
- Czeizel A.E. First 25 years of the Hungarian congenital abnormality registry. Teratology. 1997;55:299–305. [PubMed] [Google Scholar]
- Dommergues M., Mandelbrot L., Mahieu-Caputo D., Boudjema N., Durand-Zaleski I. Termination of pregnancy following prenatal diagnosis in France: how severe are the foetal anomalies? Prenat Diagn. 2010;30:531–539. [PubMed] [Google Scholar]
- Wang Y., Hu J., Druschel C.M., Kirby R.S. Twenty-five-year survival of children with birth defects in New York State: a population-based study. Birth Defects Res A Clin Mol Teratol. 2011;91:995–1003. [PubMed] [Google Scholar]
- Courtwright A. Who is “too sick to benefit”? Hastings Cent Rep. 2012;42:41–47. [PubMed] [Google Scholar]
- Goldenberg R.L., Humphrey J.L., Hale C.B. Lethal congenital anomalies as a cause of birth-weight-specific neonatal mortality. JAMA. 1983;250:513–515. [PubMed] [Google Scholar]
- Milunsky A. Lethal congenital anomalies. JAMA. 1983;250:517–518. [PubMed] [Google Scholar]
- Young I.D., Clarke M. Lethal malformations and perinatal mortality: a 10 year review with comparison of ethnic differences. BMJ. 1987;295:89–91. [PMC free article] [PubMed] [Google Scholar]
- Cunniff C., Kirby R.S., Senner J.W., Canino C., Brewster M.A., Butler B. Deaths associated with renal agenesis: a population-based study of birth prevalence, case ascertainment, and etiologic heterogeneity. Teratology. 1994;50:200–204. [PubMed] [Google Scholar]
- Parker S.E., Mai C.T., Canfield M.A., Rickard R., Wang Y., Meyer R.E. Updated national birth prevalence estimates for selected birth defects in the United States, 2004–2006. Birth Defects Res A Clin Mol Teratol. 2010;88:1008–1016. [PubMed] [Google Scholar]
- Machado I.N., Martinez S.D., Barini R. Anencephaly: do the pregnancy and maternal characteristics impact the pregnancy outcome? ISRN Obstet Gynecol. 2012;2012:127490. [PMC free article] [PubMed] [Google Scholar]
- Jaquier M., Klein A., Boltshauser E. Spontaneous pregnancy outcome after prenatal diagnosis of anencephaly. Br J Obstet Gynaecol. 2006;113:951–953. [PubMed] [Google Scholar]
- Kalucy M., Bower C., Stanley F., Burton P. Survival of infants with neural tube defects in Western Australia 1966–1990. Paediatr Perinat Epidemiol. 1994;8:334–351. [PubMed] [Google Scholar]
- Obeidi N., Russell N., Higgins J.R., O’Donoghue K. The natural history of anencephaly. Prenat Diagn. 2010;30:357–360. [PubMed] [Google Scholar]
- Tennant P.W., Pearce M.S., Bythell M., Rankin J. 20-year survival of children born with congenital anomalies: a population-based study. Lancet. 2010;375:649–656. [PubMed] [Google Scholar]
- McAbee G., Sherman J., Canas J.A., Boxer H. Prolonged survival of two anencephalic infants. Am J Perinatol. 1993;10:175–177. [PubMed] [Google Scholar]
- Koogler T.K., Wilfond B.S., Ross L.F. Lethal language, lethal decisions. Hastings Cent Rep. 2003;33:37–41. [PubMed] [Google Scholar]
- Stevenson D.A., Carey J.C., Byrne J.L.B., Srisukhumbowornchai S., Feldkamp M.L. Analysis of skeletal dysplasias in the Utah population. Am J Med Genet A. 2012;158:1046–1054. [PubMed] [Google Scholar]
- MacDonald I.M., Hunter A.G.W., MacLeod P.M., MacMurray S.B. Growth and development in thanatophoric dysplasia. Am J Med Genet. 1989;33:508–512. [PubMed] [Google Scholar]
- Baker K.M., Olson D.S., Harding C.O., Pauli R.M. Long-term survival in typical thanatophoric dysplasia type 1. Am J Med Genet. 1997;70:427–436. [PubMed] [Google Scholar]
- Houlihan O.A., O’Donoghue K. The natural history of pregnancies with a diagnosis of trisomy 18 or trisomy 13; a retrospective case series. BMC Pregn Childbirth. 2013;13:209. [PMC free article] [PubMed] [Google Scholar]
- Morris J.K., Sawa G.M. The risk of fetal loss following a prenatal diagnosis of trisomy 13 or trisomy 18. Am J Med Genet. 2008;146A:827–832. [PubMed] [Google Scholar]
- Wu J., Springett A., Morris J.K. Survival of trisomy 18 (Edwards syndrome) and trisomy 13 (Patau syndrome) in England and Wales: 2004–2011. Am J Med Genet. 2013;161A:2512–2518. [PubMed] [Google Scholar]
- Lebel R.R., Roberson J., Van Dyke D.L. Regarding trisomy 18 [1] Am J Med Genet. 2006;140A:964–965. [PubMed] [Google Scholar]
- Fenton L.J. Trisomy 13 and 18 and quality of life: treading “softly” Am J Med Genet. 2011;155A:1527–1528. [PubMed] [Google Scholar]
- Bhanumathi B., Goyel N.A., Mishra Z.A. Trisomy 18 in a 50-year-old female. Ind J Hum Genet. 2006;12:146–147. [Google Scholar]
- Redheendran R., Neu R.L., Bannerman R.M. Long survival in trisomy-13 syndrome: 21 cases including prolonged survival in two patients 11 and 19 years old. Am J Med Genet. 1981;8:167–172. [PubMed] [Google Scholar]
- Tunca Y., Kadandale J., Pivnick E. Long-term survival in Patau syndrome. Clin Dysmorphol. 2001;10:149. [PubMed] [Google Scholar]
- Szabó N., Gergev G., Kóbor J., Szucs P., Túri S., Sztriha L. Holoprosencephaly in Hungary: birth prevalence and clinical spectrum. J Child Neurol. 2011;26:1029–1032. [PubMed] [Google Scholar]
- Barr M., Jr., Cohen M.M., Jr. Holoprosencephaly survival and performance. Am J Med Genet. 1999;89:116–120. [PubMed] [Google Scholar]
- Veneselli E., Biancheri R., Di Rocco M., Fondelli M.P., Perrone M.V., Donati P.T. Unusually prolonged survival and childhood-onset epilepsy in a case of alobar holoprosencephaly. Child’s Nerv Syst. 1999;15:274–277. [PubMed] [Google Scholar]
- Stashinko E.E., Clegg N.J., Kammann H.A., Sweet V.T., Delgado M.R., Hahn J.S. A retrospective survey of perinatal risk factors of 104 living children with holoprosencephaly. Am J Med Genet. 2004;128A:114–119. [PubMed] [Google Scholar]
- Irving C., Richmond S., Wren C., Longster C., Embleton N.D. Changes in fetal prevalence and outcome for trisomies 13 and 18: a population-based study over 23 years. J Matern Fetal Neonatal Med. 2011;24:137–141. [PubMed] [Google Scholar]
- Wilkinson D. The self-fulfilling prophecy in intensive care. Theor Med Bioethics. 2009;30:401–410. [PubMed] [Google Scholar]
- McCaffrey M.J. Lethality begets lethality. J Perinatol. 2011;31:630–631. [PubMed] [Google Scholar]
- Merritt T.A., Catlin A., Wool C., Peverini R., Goldstein M., Oshiro B. Trisomy 18 and trisomy 13: treatment and management decisions. NeoReviews. 2012;13:e40–e48. [Google Scholar]
- Sibiude J., Gavard L., Floch-Tudal C., Mandelbrot L. Perinatal care and outcome of fetuses with trisomies 13 and 18 following a parental decision not to terminate the pregnancy. Fetal Diagn Ther. 2011;29:233–237. [PubMed] [Google Scholar]
- Lakovschek I.C., Streubel B., Ulm B. Natural outcome of trisomy 13, trisomy 18, and triploidy after prenatal diagnosis. Am J Med Genet A. 2011;155:2626–2633. [PubMed] [Google Scholar]
- Burke A.L., Field K., Morrison J.J. Natural history of fetal trisomy 18 after prenatal diagnosis. Archs Dis Child Fetal Neonatal Ed. 2013;98:F152–F154. [PubMed] [Google Scholar]
- Boghossian N.S., Hansen NI., Bell EF., Stoll BJ., Murray JC., Carey JC. Mortality and morbidity of VLBW infants with trisomy 13 or trisomy 18. Pediatrics. 2014;133:226–235. [PMC free article] [PubMed] [Google Scholar]
- Maeda J., Yamagishi H., Furutani Y., Kamisago M., Waragai T., Oana S. The impact of cardiac surgery in patients with trisomy 18 and trisomy 13 in Japan. Am J Med Genet. 2011;155A:2641–2646. [PubMed] [Google Scholar]
- Wilkinson D.J., de Crespigny L., Lees C., Savulescu J., Thiele P., Tran T. Perinatal management of trisomy 18: a survey of obstetricians in Australia, New Zealand and the UK. Prenat Diagn. 2014;34:42–49. [PMC free article] [PubMed] [Google Scholar]
- Guon J., Wilfond B.S., Farlow B., Brazg T., Janvier A. Our children are not a diagnosis: the experience of parents who continue their pregnancy after a prenatal diagnosis of trisomy 13 or 18. Am J Med Genet. 2014;164A:308–318. [PubMed] [Google Scholar]
- Farlow B., Misgivings Hastings Cent Rep. 2009;39:19–21. [PubMed] [Google Scholar]
- Thiele P. He was my son, not a dying baby. J Med Ethics. 2010;36:646–647. [PubMed] [Google Scholar]
- Walker L.V., Miller V.J., Dalton V.K. The health-care experiences of families given the prenatal diagnosis of trisomy 18. J Perinatol. 2008;28:12–19. [PubMed] [Google Scholar]
- Janvier A., Farlow B., Wilfond B.S. The experience of families with children with trisomy 13 and 18 in social networks. Pediatrics. 2012;130:293–298. [PubMed] [Google Scholar]
- Wilkinson D.J.C., Savulescu J. Knowing when to stop: futility in the ICU. Curr Opin Anaesthesiol. 2011;24:160–165. [PMC free article] [PubMed] [Google Scholar]
- Schneiderman L.J., Jecker N.S., Jonsen A.R. Medical futility: its meaning and ethical implications. Ann Intern Med. 1990;112:949–954. [PubMed] [Google Scholar]
- Brody B.A., Halevy A. Is futility a futile concept? J Med Philosophy. 1995;20:123–144. [PubMed] [Google Scholar]
- Helft P.R., Siegler M., Lantos J. The rise and fall of the futility movement. N Engl J Med. 2000;343:293–296. [PubMed] [Google Scholar]
- Boss R.D., Holmes K.W., Althaus J., Rushton C.H., McNee H., McNee T. Ethics rounds. Trisomy 18 and complex congenital heart disease: seeking the threshold benefit. Pediatrics. 2013;132:161–165. [PubMed] [Google Scholar]
- Youngner S.J. Who defines futility? JAMA. 1988;260:2094–2095. [PubMed] [Google Scholar]
- Babnik J. Textbook of perinatal medicine. Parthenon; London: 1998. Ethical decisions in the delivery room; pp. 1880–1885. [Google Scholar]
- Chervenak F.A., McCullough L.B. The fetus as a patient: an essential ethical concept for maternal–fetal medicine. J Maternal–Fetal Neonat Medicine. 1996;5:115–119. [PubMed] [Google Scholar]
- Liang C.A., Braddock B.A., Heithaus J.L., Christensen K.M., Braddock S.R., Carey J.C. Reported communication ability of persons with trisomy 18 and trisomy 13. Dev Neurorehabil. 2013 Nov 1 [Epub ahead of print] [PubMed] [Google Scholar]
- Janvier A., Okah F., Farlow B., Lantos J.D. An infant with trisomy 18 and a ventricular septal defect. Pediatrics. 2011;127:754–759. [PubMed] [Google Scholar]
- Caplan A. Neutrality is not morality: the ethics of genetic counselling. In: Bartels D., LeRoy B., Caplan A., editors. Prescribing our future: ethical challenges in genetic counselling. Aldine De Gruyter; Hawthorne: 1993. [Google Scholar]
- Elwyn G., Gray J., Clarke A. Shared decision making and non-directiveness in genetic counselling. J Med Genet. 2000;37:135–138. [PMC free article] [PubMed] [Google Scholar]
- Resta R.G. Eugenics and nondirectiveness in genetic counseling. J Genet Couns. 1997;6:255–258. [PubMed] [Google Scholar]
- Rentmeester C.A. Value neutrality in genetic counseling: an unattained ideal. Med Health Care Philos. 2001;4:47–51. [PubMed] [Google Scholar]
- Williams DL., Gelijns AC., Moskowitz AJ., Weinberg AD., Ng JH., Crawford E. Hypoplastic left heart syndrome: valuing the survival. J Thorac Cardiovasc Surg. 2000;119:720–731. [PubMed] [Google Scholar]
- Bernhardt B.A. Empirical evidence that genetic counseling is directive: where do we go from here? Am J Hum Genet. 1997;60:17–20. [PMC free article] [PubMed] [Google Scholar]
- De Crespigny L. Words matter. Nomenclature and communication in perinatal medicine. Clin Perinatol. 2003;30:17–25. [PubMed] [Google Scholar]
- Breeze A.C., Lees C.C. Antenatal diagnosis and management of life-limiting conditions. Semin Fetal Neonatal Med. 2013;18:68–75. [PubMed] [Google Scholar]
- Wilkinson D. Oxford University Press; Oxford: 2013. Death or disability? The Carmentis Machine and treatment decisions for critically ill children. [Google Scholar]
- British Association of Perinatal Medicine . British Association of Perinatal Medicine; London: 2010. Palliative care (supportive and end of life care): a framework for clinical practice in perinatal medicine. [Google Scholar]
- Kutzsche S., Partridge J.C., Leuthner S.R., Lantos J.D. When life-sustaining treatment is withdrawn and the patient doesn’t die. Pediatrics. 2013;132:893–897. [PubMed] [Google Scholar]
- Cote-Arsenault D., Denney-Koelsch E. “My baby is a person”: parents’ experiences with life-threatening fetal diagnosis. J Palliat Med. 2011;14:1302–1308. [PubMed] [Google Scholar]
- Kilby M.D., Pretlove S.J., Bedford Russell A.R. Multidisciplinary palliative care in unborn and newborn babies. BMJ. 2011;342:d1808. [PubMed] [Google Scholar]
- Heuser C.C., Eller A.G., Byrne J.L. Survey of physicians’ approach to severe fetal anomalies. J Med Ethics. 2012;38:391–395. [PubMed] [Google Scholar]
- Chervenak F.A., McCullough L.B. Nonaggressive obstetric management. An option for some fetal anomalies during the third trimester. JAMA. 1989;261:3439–3440. [PubMed] [Google Scholar]
- Chervenak F.A., McCullough L.B. Ethical dimensions of non-aggressive fetal management. Semin Fetal Neonatal Med. 2008;13:316–319. [PubMed] [Google Scholar]
- Spinnato J.A., Cook V.D., Cook C.R., Voss D.H. Aggressive intrapartum management of lethal fetal anomalies: beyond fetal beneficence. Obstet Gynecol. 1995;85:89–92. [PubMed] [Google Scholar]
- Wilkinson D.J.C. Antenatal diagnosis of trisomy 18, harm and parental choice. J Med Ethics. 2010;36:644–645. [PubMed] [Google Scholar]
- Kumar P. Care of an infant with lethal malformation: where do we draw the line? Pediatrics. 2011;128:e1642–e1643. [PubMed] [Google Scholar]
- Strong C. Fetal anomalies: ethical and legal considerations in screening, detection, and management. Clin Perinatol. 2003;30:113–126. [PubMed] [Google Scholar]
- Tex Health and Safety Code. Section A170.002 Prohibited Acts; exemption [available at: http://www.statutes.legis.state.tx.us/Docs/SDocs/HEALTHANDSAFETYCODE.pdf], eff. September 1, 1999.
- Texas Health and Safety Code. Section 285.202 Use of tax revenue for abortions; exception for medical emergency [available at: http://www.weblaws.org/texas/laws/tex._health_and_safety_code_section_285.202_use_of_tax_revenue_for_abortions;_exception_for_medical_emergency], eff. September 28, 2011.
- Women’s Link Worldwide, C-355/2006 . 2007. Women’s Link Worldwide.http://www.womenslinkworldwide.org/pdf_pubs/pub_c3552006.pdfaccessed at: on February 19, 2014. [Google Scholar]
- Human Rights Watch, Brazil. Supreme Court abortion ruling a positive step: expands exceptions to criminal penalties to include fatal disorder of fetus [available at: http://www.hrw.org/news/2012/04/19/brazil-supreme-court-abortion-ruling-positive-step]; April 19, 2012.
- Savulescu J. Is current practice around late termination of pregnancy eugenic and discriminatory? Maternal interests and abortion. J Med Ethics. 2001;27:165–171. [PMC free article] [PubMed] [Google Scholar]
- Bienstock J.L., Birsner M.L., Coleman F., Hueppchen N.A. Successful in utero intervention for bilateral renal agenesis. Obstet Gynecol. 2014;124(2 Pt 2):413–415. [PubMed] [Google Scholar]
- Song K. Survival of Rep. Herrera Beutler’s child a celebrated case study. Seattle Times. 23 August 2014 available at http://seattletimes.com/html/localnews/2024377057_herrerabeutlerxml.html. [Google Scholar]



