Fin mai 2021, le New England Journal of Medicine (NEJM) a publié l’article de Frenck et al. titré « Sécurité, immunogénicité et efficacité du vaccin BNT162b2 chez les adolescents », présentant le résultat des essais du vaccin anti-Covid de Pfizer/BioNTech sur les jeunes de 12 à 15 ans.
On en propose ici une lecture critique.
Il s’agit d’un essai contrôlé randomisé, au cours duquel un groupe de 1131 jeunes a reçu deux doses vaccin espacées de 3 semaines, tandis qu’un groupe contrôle de 1129 jeunes recevait deux injections de « placebo » (une solution saline sans vaccin).
(Ouvrons une parenthèse pour expliciter un point qui n’est pas forcément clair pour tout le monde : un essai ne consiste pas à regrouper les sujets volontaires pendant des mois dans un centre d’examens médicaux en les surveillant 24h/24. Les sujets rencontrent les chercheurs plusieurs fois, pour procéder aux prises du produit testé ou pour faire les analyses prévues par le protocole expérimental, mais entre deux rendez-vous, les sujets participant à l’essai continuent à mener leur vie habituelle. Ils ont parfois des questionnaires à remplir, par exemple, et ils peuvent prendre contact avec l’équipe de recherche s’ils le jugent utile.)
Entrons maintenant dans l’examen de l’article.
Les conclusions du résumé qui précède l’article présentent de très bons résultats :

Agrandissement : Illustration 1

« Chez les sujets de 12 à 15 ans, le vaccin BNT162b2 a présenté un profil de sécurité favorable, produit une plus forte réponse immunitaire que chez les jeunes adultes, et s’est montré très efficace contre le Covid-19 » (Fig.1) La fin de l’article, dans la partie « discussion », mentionne quelques limites de l’étude.

Agrandissement : Illustration 2

En particulier, il est précisé que « les données sur la sécurité à long terme et sur la durée de l’efficacité et de la présence d’anticorps chez les enfants ne sont pas encore disponibles » (Fig.2) et que « ces résultats ne permettent pas de déterminer si le vaccin BNT52b2 protège contre l’infection asymptomatique ou la transmission du SARS-CoV-2 » (Fig.3)

Agrandissement : Illustration 3

Efficacité
Deux façons de mesurer l’efficacité du vaccin ont été utilisées par l’équipe de chercheurs : 1° la mesure de la production d’anticorps par les personnes vaccinées, et 2° la comparaison du nombre de contaminations entre les jeunes du groupe placebo et les jeunes vaccinés.
- On n’entrera pas ici dans le détail de la méthode de mesure des anticorps, ni dans le principe de la comparaison avec les groupes de patients de 16 à 25 ans inclus dans les premiers essais menés sur le vaccin. On se contentera de constater qu’en effet, un mois après la deuxième dose, les personnes vaccinées avaient en moyenne une quantité d’anticorps nettement supérieure à celles du groupe placebo. Le tableau 2 (« Table 2 ») de l’article indique toutefois que la mesure n’a été menée que sur 190 sujets, et n’indique pas si tous les sujets vaccinés chez qui la mesure a été faite avaient vu une augmentation de leur taux d’anticorps (Fig.4).

Agrandissement : Illustration 4

Remarque : les essais ont été menés aux USA, entre le 15 octobre 2020 et le 12 janvier 2021, à une époque où peu de variants avaient été repérés. On ne sait pas dans quelle mesure les anticorps générés — en réaction à la protéine Spike utilisée pour concevoir le vaccin BNT162b2 — seront neutralisants face à des virus portant des protéines Spike modifiées par des mutations successives.
- le nombre de contaminations par le Covid-19 a été mesuré et rapporté à partir de la première injection. C’est le nombre de contaminations observées dans chaque groupe plus de 7 jours après la deuxième injection qui sert à mesurer l’efficacité du vaccin. En effet, on considère que la vaccination n’est complète que lorsque le système immunitaire a eu le temps de régir au vaccin, et cela n’est accompli que quelques jours après la deuxième dose.
Qu’est-ce qui a été compté comme contamination par les chercheurs ? Le Supplementary Appendix que l’on peut télécharger depuis l’article, répond à cette question, p.3 :

Agrandissement : Illustration 5

si un sujet de l’étude développait une maladie respiratoire aiguë, alors on cherchait une confirmation par un test de dépistage de type PCR, effectué entre 4 jours avant ou après les premiers symptômes. Si le test était positif et que le patient présentait au moins un symptôme parmi une liste précise (mal de gorge, fièvre, frissons, anosmie/agueusie, diarrhée, vomissements…) on considérait qu’il s’agissait d’une contamination au Covid-19 (Fig.5).
Remarque : pour évaluer l’efficacité du vaccin, ne sont donc comptées que des formes symptomatiques de Covid-19. L’article ne parle d’aucun suivi systématique des deux groupes par des tests réguliers, par exemple, qui aurait pu indiquer une efficacité sur les contaminations y compris asymptomatiques, et éventuellement sur une capacité des sujets vaccinés à transmettre le virus..
- Comme le montre le tableau S3 du Supplementary Appendix (Fig.6), davantage de sujets ont été infectés (de façon symptomatique, comme on vient de le voir) dans le groupe placebo que dans le groupe vacciné.

Agrandissement : Illustration 6

Les trois seules contaminations observées dans le groupe de 1131 jeunes vaccinés (1ère colonne de chiffres) l’ont été dans les 10 jours suivant la première dose. Plus aucune contamination n’a été observée dans ce groupe à partir du 11ème jour suivant la première dose (et aucune dans les 4 mois suivant la deuxième dose.) Dans le groupe de 1129 jeunes ayant reçu un placebo, 35 contaminations ont été enregistrées : 12 (c’est-à-dire 4 +8) durant les 3 semaines entre la 1ère et la 2ème dose, et 23 (5, puis 16, puis 2) dans les quatre mois suivant la deuxième dose. (Sur la Fig.6, on a cerclé les cas de contamination observés : les autres chiffres des deux colonnes colonnes concernées correspondent à des sous-totaux ou à des totaux généraux.)
Remarque : le fait qu’aucun sujet vacciné n’ait été infecté après les 10 jours suivants la 1ère dose peut soulever la question de la nécessité de la deuxième dose. Mais le nombre de sujets dans l’essai n’est sans doute pas suffisant pour y répondre.
- Enfin, l’article précise qu’aucun cas grave de Covid-19 n’a été observé, ni dans le groupe vacciné, ni dans le groupe placebo.
Synthèse générale sur l’efficacité du vaccin : l’essai a pu montrer que les jeunes vaccinés produisaient comme prévu des anticorps neutralisants, ce qui semblait les mettre à l'abri du risque de connaître des symptômes légers dus à une infection au Covid.
Mais l’essai ne donne aucune indication quant à un effet du vaccin sur les infections à forme asymptomatique ou sur la capacité à transmettre le virus, ni en ce qui concerne l’efficacité du vaccin face à d’éventuels variants, ni sur un éventuel effet protecteur contre les Covid longs. Quant aux formes sévères de Covid-19, il est à peu près établi qu’avec les variants connus jusqu’ici, les jeunes ont extrêmement peu de risque de les contracter, et il est à peu près impossible d’espérer montrer une réduction d’un risque déjà proche de zéro. C’est donc sans surprise que l’essai ne montre pas de réduction de ce risque par le vaccin.
Sécurité
C’est sans doute sur le plan de la sécurité que la lecture attentive de l’étude de Pfizer soulève le plus de questions.
La sécurité des vaccins est abordée dans l’étude sous deux angles : la réactogénicité (que l’on peut comprendre comme les effets secondaires dus à la mobilisation du système immunitaire, et normalement attendus après une injection vaccinale) et les événement indésirables (« adverse events »), qui seraient des réactions non prévues, se traduisant par une détérioration passagère ou définitive de la santé.
Réactogénicité
L’article de Frenck et al. détaille dans sa Figure 2 le nombre de réactions normalement attendues (douleur dans la zone d’injection, fièvre, courbatures, fatigue etc.) pour chacun des deux groupes (en les comparant aussi avec les groupes de patients de 16 à 25 ans inclus dans une autre étude, mais on ne s’attardera pas sur ce point.) Il constate que le groupe vacciné montre davantage d’effets de ce type, ce qui n’est pas surprenant. Un cas est brièvement mentionné dans le paragraphe Reactogenicity, avant d’être développé plus bas, en tant qu’événement indésirable : le lendemain de la 1ère dose, un jeune vacciné a connu un épisode de fièvre dépassant 40°.
Remarque : comme indiqué au paragraphe "Safety" dans la partie "Methods" de l'article, les chercheurs avaient fourni aux sujets de l’étude des outils de recueil des réactions et des effets indésirables : des « agendas électroniques » ("e-diary"), où les sujets participant à l’essai étaient censés indiquer tous les effets et réactions constatés. Mais cet outil ne concernait que les 7 jours suivant chaque injection. Si un effet survenait en-dehors de ces deux plages temporelles, son signalement était considéré comme « non sollicité ». Si le sujet en faisait part à l’équipe de recherche, il était néanmoins pris en compte, jusqu’à un mois après la deuxième injection pour un événement indésirable, et jusqu’à 6 mois si l'événement indésirable était grave.
Événements indésirables
L’article indique que les événements indésirables survenus dans chacun des groupe (vacciné et placebo) ont été enregistré depuis la première injection jusqu’à un mois après la seconde, et qu’environ 6 % des participants ont rapporté de tels événements.
Une notion mérite d’être abordée : certains événements sont considérés comme « liés aux produits testés» (« related to investigational product » ou simplement « related » ) tandis que d’autres non.
On peut en effet concevoir qu’une crise d’anxiété, par exemple, puisse être déclarée comme un événement indésirable, sans être liée au produit (vaccin ou placebo) ; mais qu’en revanche, une réaction allergique puisse être liée au produit (vaccin ou placebo.)
L’article indique « qu’un peu plus » d’événements liés au vaccin ont été signalé dans le groupe vacciné : 3 % contre 2 %, et il mentionne, pour comparaison, les pourcentages observés sur les jeunes de 16 à 25 ans lors de l’étude principale sur les adultes.
Remarque : la façon de jouer avec les pourcentages n’est pas neutre : certes, 3 % c’est un peu plus que 2 % : c’est une petite différence de 1 %. Mais 3 % c’est une fois et demie 2 %. C’est donc une augmentation de 50 % par rapport à 2%. Les chercheurs écrivent que les vaccinés ont rapporté « légèrement plus » d’événements indésirables que le groupe placebo. Ils auraient pu écrire que « les vaccinés ont rapporté 50 % d’événements de plus par rapport au groupe placebo ».
Cela implique les notions de réduction du risque absolue et de réduction du risque relative. Par exemple, pour le premier essai du vaccin Pfizer/BionNTech sur les adultes, les chercheurs avaient observé (voir le tableau S4 du Supplementary appendix de cette étude) que parmi les 18198 sujets vaccinés, 8 avaient été infectés par le Covid-19 (0,04% des sujets vaccinés) contre 162 parmi les 18325 sujets du groupe placebo (0,88% des sujets du groupe.) Entre 0,88 % et 0,04 %, on constate une baisse absolue de 0,84 % du risque. Les chercheurs pouvaient donc soit conclure qu’il y avait « un peu moins » de sujets infectés parmi les vaccinés que chez les non vaccinés, soit parler de la réduction du risque relative et afficher une « baisse de 95 % » des contaminations : en effet puisque si on réduit 0,88 de 95 %, on obtient 0,04.
Ainsi, quand il s’est agi de parler des bénéfices du vaccin, Pfizer a communiqué sur la réduction du risque relative ("95 % de baisse", plutôt que 0,84% de réduction), mais quand il s’agit de parler d’effets indésirables, Pfizer communique sur l’augmentation du risque absolue (« une légère hausse » de 1 %, plutôt que 50% d’augmentation.)
Notons que les deux formulations, absolue et relative, sont vraies, mais qu’il importe de préciser de quoi on parle. Et que bien sûr, puisque peu de gens sont conscients de la différence, l’impact médiatique et psychologique de ces deux façons de présenter les mêmes chiffres n’est pas le même.
C’est par exemple à propos de ce genre de choix de présentation qu’il convient de s’interroger sur ce qui peut influencer les chercheurs impliqués dans une étude scientifique. Si d’autres influences que la quête de l’exactitude scientifique peuvent les pousser à pencher (volontairement ou non, consciemment ou non) d’un côté plutôt que de l’autre et à être enclin à éclairer un produit sous un jour favorable ou défavorable, il importe de le savoir. C’est pour cela que la déclaration des conflits d’intérêt est rendue obligatoire lors de publications scientifiques.
Comme on le va le voir plus loin, le choix de présentation entre réduction absolue ou relative du risque n’est pas la question la plus grave sur laquelle les conflits d’intérêts peuvent peser.
L’article de Frenck et al. poursuit la description des événements indésirables :
- il revient sur le cas d’un garçon de 14 ans ayant eu un fort accès de fièvre lié à l’injection de la première dose de vaccin, le lendemain de celle-ci : sa température a atteint 40,4°, mais elle était retombé en deux jours. On nous dit que ce sujet a abandonné l'essai et n’a pas reçu la deuxième dose, mais qu'il est resté inclus dans l’étude pour la partie concernant la sécurité du vaccin.
- il mentionne 9 cas de lymphadénopathie (gonflement de ganglions lymphatiques) dans le groupe vacciné contre 2 dans le groupe placebo.
- il précise qu’aucune thrombose, aucun choc anaphylactique n’ont été signalés.

Agrandissement : Illustration 7

- avant de terminer en mentionnant qu’aucun décès n’avait été rapporté, il signale que « peu » de sujets de l’étude (« moins de 0,4% jusqu’à un mois après la 2ème dose ») avaient connu des événements indésirables graves, et qu’aucun de ceux-ci n’avait été considéré par les chercheurs comme lié au vaccin (Fig.7)
A la lecture de ces paragraphes, on est tenté de comprendre que le vaccin semble ne pas avoir posé de problèmes.
Pourtant, plusieurs de ces points méritent que l’on s’y penche.
Il faut pour cela se reporter aux données sur les événements indésirables fournies par le tableau S2 du Supplementary Appendix.
Comme souvent dans cette étude, on y trouve, en plus des données de l’essai sur les jeunes de 12 à 15 ans, les données concernant les jeunes de 16 à 25 ans inclus dans une étude précédente. On se concentrera ici sur les colonnes concernant les jeunes de 12 à 15 ans.
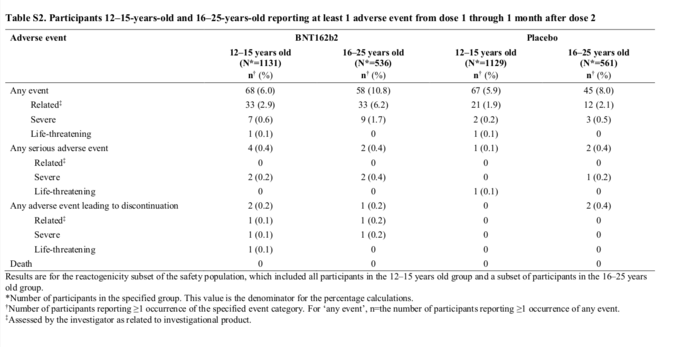
Agrandissement : Illustration 8
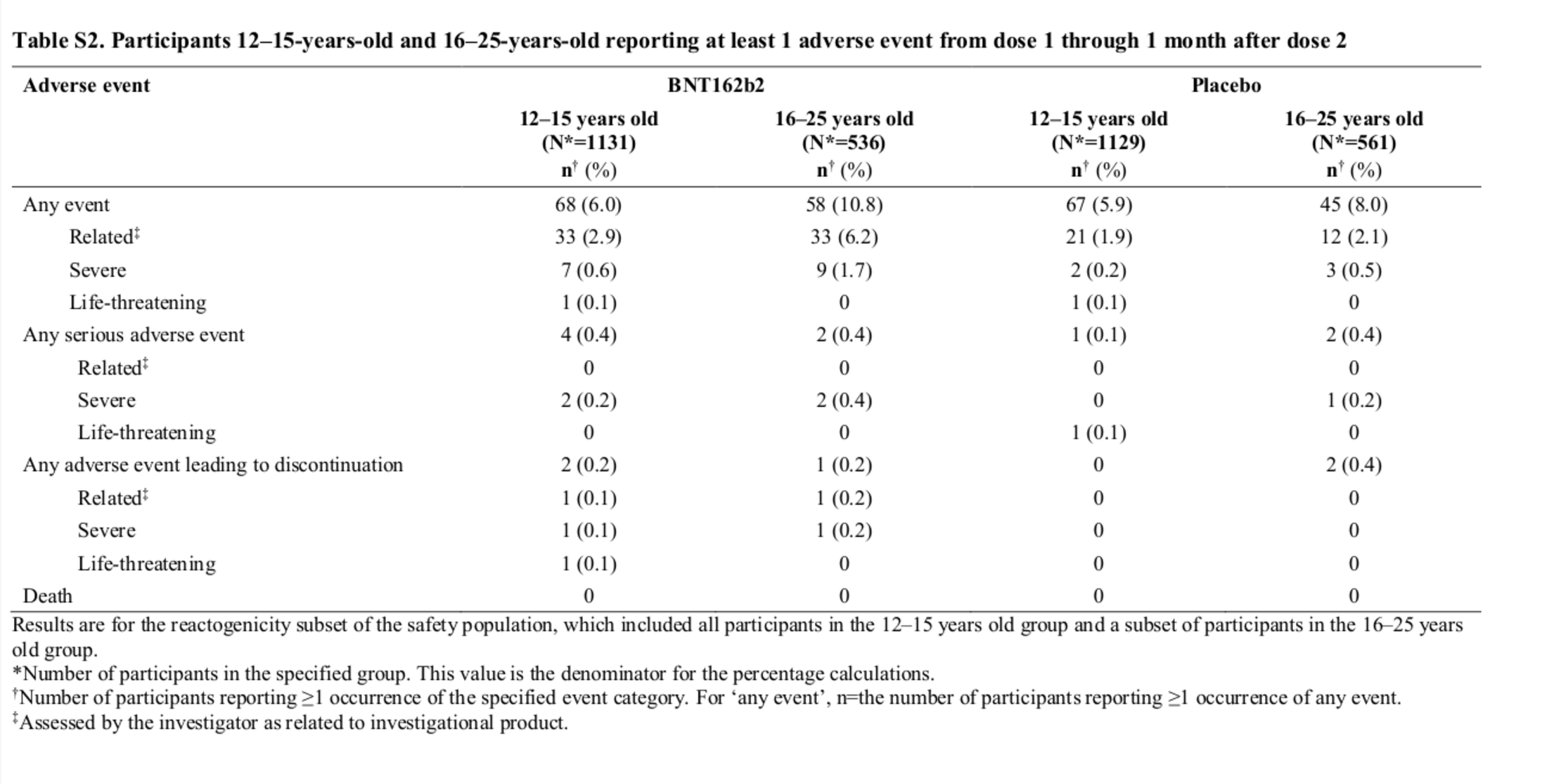
Les données sur les événements indésirabes sont présentées en 4 groupes : « Événements » (« Any event »), « Événements graves » (« Any serious adverse event »), « Événements ayant conduit à interrompre la participation à l’essai » et « Décès » (« Death »). Hormis pour cette dernière ligne, les Événements sont subdivisés en trois catégories, qui peuvent se recouper : « lié au produit » (« Related »), « Sérieux » (« Severe ») et « Ayant mis la vie en danger » (« Life-threatening ») (Fig.8)
Logiquement, on retrouve derrière ces chiffres le garçon de 14 ans qui a arrêté l’essai suite à une fièvre de 40,4° : il est vraisemblablement le cas (parmi les deux abandons suite à des événements indésirables) considéré comme « lié » au vaccin, et sans doute comme pour qui la vie a été mise en danger. (Cet aspect n’est pas explicité dans le corps de l’article, mais en effet, un tel niveau de fièvre est critique.)
Une première remarque : parmi le groupe vacciné, 4 événements graves (« serious ») se sont produits, contre 1 dans le groupe placebo. C’est — selon l’approche absolue ou relative — 3 événements de plus chez les vaccinés, ou un taux d’événements grave de 300 % plus élevé chez les vaccinés que dans le groupe placebo.
Le hasard suffit-il à expliquer que, sur un groupe de 1131 adolescents, 4 graves problèmes de santé surviennent sur un laps de temps de 6 mois ? Les chercheurs l’ont sans doute estimé, puisqu’ils ont considéré qu’aucun des 4 événements n’était lié au vaccin.
La deuxième remarque s’ensuit : il appartient aux chercheurs travaillant sur l’essai clinique de déterminer si un événement indésirable est lié au vaccin ou s’il ne l’est pas. C'est ce que rappelle la dernière petite note en bas du tableau S2, à laquelle renvoient chaque ligne « related » (Fig.8) : « Jugé par le chercheur comme lié au produit expérimenté ».
Cette question est d’une importance cruciale, tant les enjeux sont colossaux.
Il est à peu près évident que sur un gros millier d’adolescents testés, il suffirait qu’un seul cas d’événement indésirable grave soit présenté comme lié au vaccin pour remettre en cause non seulement les autorisations de mise sur le marché du vaccin pour les jeunes, mais aussi probablement toute la réputation des vaccins anti-Covid, à commencer par celui de Pfizer/BioNTech.
Ainsi, pour chaque cas d’événement indésirable grave survenu chez un jeune vacciné durant l’essai clinique, les chercheurs qui devaient dire si, oui ou non, l’événement était lié au vaccin, avaient une responsabilité immense sur les épaules : écarter le lien alors que l’événement était dû au vaccin, c’était prendre le risque de voir par la suite des milliers, voire des millions de jeunes vaccinés connaître le même type d’accident partout dans le monde ; inversement, attribuer au vaccin la cause d’un événement, que ce soit à tort ou à raison, c’était porter un coup fatal à la stratégie vaccinale planétaire et, accessoirement, à un marché de plusieurs dizaines de milliards de dollars pour Pfizer et BionNTech.
En particulier, si survient un accident de santé dont rien ne permet, en l’état des connaissances sur les mécanismes d’action du vaccin et de ses adjuvants, de comprendre qu’un lien existe, quel sera le verdict ?
Par exemple, au moment des essais, l’idée qu’une myocardite ou une péricardite puissent être provoquées par le vaccin n’avait semble-t-il jamais été évoquée. Aucune des études pointant la toxicité des protéines Spike elles-mêmes (ici ou là) n’avait encore été publiée. Face à un symptôme d'apparence totalement incongrue dans le cas d'une injection d'ARNm, les chercheurs pouvaient-ils supposer l’existence d’un lien ?
Autre exemple, dans l’étude, il n’est nulle part question de mesure des D-dimères sur les sujets après les injections : cette mesure, faite sur un prélèvement sanguin, aurait permis de détecter d'éventuels troubles de la coagulation, troubles qui peuvent survenir sans être perçus s’ils ne causent pas de dégâts massifs tels que des thromboses.
Plus généralement, comment les chercheurs tranchent-ils en cas de doute ?
On le devine, la question des conflits d’intérêts peut ici être particulièrement aiguë. Face aux marges de manœuvre laissées dans les cas incertains, ou rien ne prouve un lien ni une absence de lien, un chercheur dont l’avenir professionnel n’est en aucun cas impacté par son jugement, et un chercheur dont la carrière dépend des réponses qu’il apporte, n’auront pas nécessairement la même façon de trancher.
Ici, aucun détail n’est apporté sur la nature des événements graves, et on ne pourra que garder une interrogation : aucun des 4 événements graves n’était-il vraiment lié au vaccin ?
En revanche, l’article et ses annexes apportent des informations précises sur une autre dimension de cet essai.
Conflits d’intérêts
En téléchargeant les « disclosure forms », disponibles parmi le « supplementary material » en fin d’article, on peut lire que, parmi les 26 chercheurs et auteurs impliqués dans l’essai et dans l’article qui en rend compte, seuls 3 ne déclarent aucun conflit d’intérêt : 18 sont des employés de Pfizer ou de BioNTech, 3 autres reçoivent des subventions de Pfizer, et 16 chercheurs possèdent des actions ou des stock options dans au moins l’une des deux entreprises.
On est manifestement dans une situation de conflit d’intérêts : la majorité des chercheurs était susceptibles de se trouver dans une situation ou leurs propres intérêts seraient en contradiction les uns avec les autres.
Un paragraphe du Supplementary Appendix, page 3, vient clarifier encore les choses : « Pfizer avait la responsabilité de la conception et de la conduite de l’étude, de la collecte, de l’analyse et de l’interprétation des données et de la rédaction de cet article. » (Fig.9)

Agrandissement : Illustration 9

La même phrase se retrouve d’ailleurs dans l’article de Polack et al. concernant les premiers essais menés sur le vaccin de Pfizer/BioNTech sur des sujets de 16 à 91 ans (dans le paragraphe « Methods »)
Un situation de conflits d’intérêts similaire à celle de l'étude de Frenck et al. concernait d’ailleurs l’équipe de l'étude de Polack et al., comme le révèlent les « disclosure forms ».
Conclusion
L’étude sur les essais du vaccin de Pfizer/BioNTech sur les adolescents, tout comme celle sur les personnes âgées de 16 ans et plus, est conçue, contrôlée, interprétée et rédigée par une des entreprises qui produisent et commercialisent ce vaccin, et les enjeux commerciaux de cette étude se chiffrent en dizaines de milliards de dollars.
La présentation de l’étude est entièrement favorable au vaccin, bien qu'elle reconnaisse ne fournir aucune indication sur d'éventuels effets indésirables à long terme ni sur une réduction du risque d'attraper et de transmettre le virus, et bien que les données chiffrées, aussi peu détaillées et explicites qu’elles soient, soulèvent de sérieuses questions.
En particulier, le choix des rédacteurs de l’article, lorsqu’ils qui concluent à un « profil de sécurité favorable » du vaccin, ne tient pas compte du fait que parmi 1131 adolescents vaccinés, un sujet de 14 ans — du fait du vaccin, selon Pfizer même — a connu un épisode de fièvre extrême mettant sa vie en danger. Cette conclusion de l’étude repose en outre sur l’estimation — faite par des chercheurs qui se trouvaient sous le contrôle de l’entreprise Pfizer — qu’aucun des 4 graves événements de santé, intervenus durant les 6 mois de l’étude parmi les 1131 adolescents ayant reçu une injection, ne pouvait être lié au vaccin. Sans justifier de cette absence de lien.
Faut-il se satisfaire d’une telle étude pour envisager une extension de la vaccination aux adolescents ?



