
Agrandissement : Illustration 1

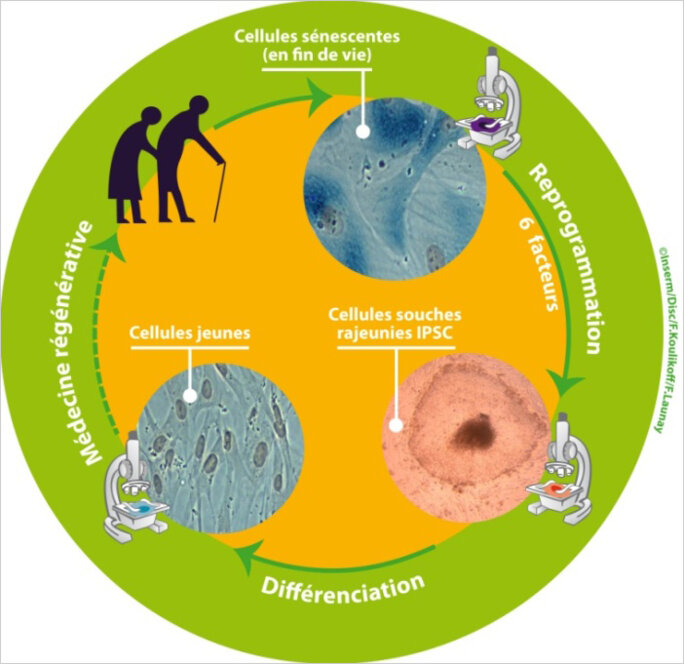
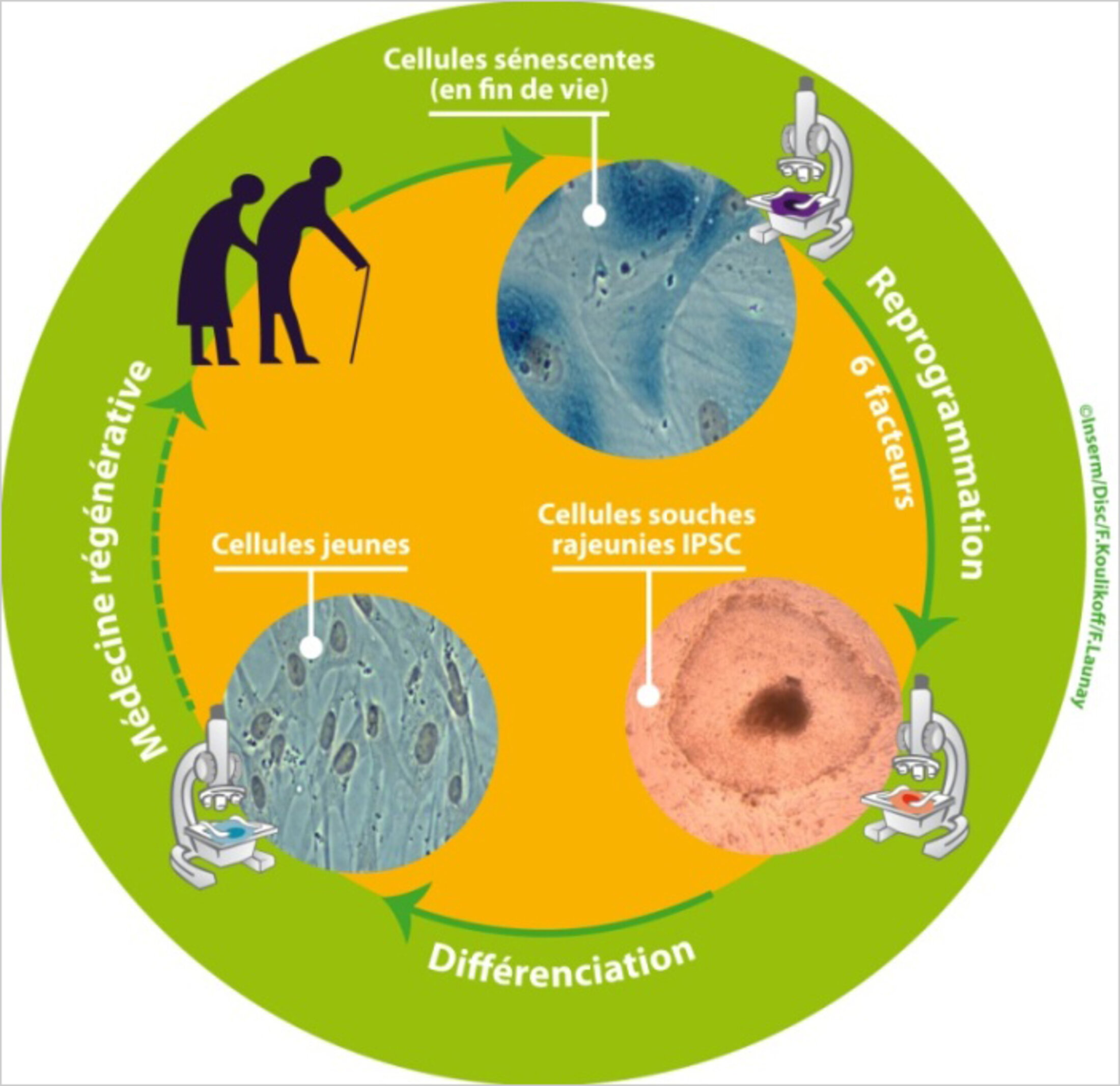
Demain, les centenaires pourront-ils régénérer leur organisme grâce à leurs propres cellules, rajeunies par un processus de «reprogrammation» génétique? Telle est la perspective futuriste ouverte par une expérience que vient de réaliser une équipe de généticiens français dirigée par Jean-Marc Lemaitre (équipe «Avenir» Inserm/CNRS/Université de Montpellier). Ces chercheurs ont prélevé des fibroblastes (cellules de la peau) chez des donneurs âgés de 74 à 101 ans. Ils ont mis ces cellules en culture et leur ont administré une combinaison de six gènes qui ont transformé leurs propriétés biologiques. Normalement, les cellules des sujets âgés deviennent sénescentes et percent leur capacité à se diviser et à former de nouvelles cellules. Mais les fibroblastes traités par le cocktail génétique des chercheurs de Montpellier ont été «reprogrammés» de telle manière qu'ils peuvent à nouveau se diviser, et peuvent même se différencier pour donner n'importe quel tissu de l'organisme, muscle, os, tissu cérébral, etc. En somme, ces cellules sont en quelque sorte remontées dans le temps et sont devenues l'équivalent des cellules de l'embryon précoce. Potentiellement, ces fibroblastes reprogrammés pourraient servir, par exemple, à régénérer un cœur fatigué, ou un cerveau frappé par la maladie de Parkinson.
Magique ? Pas tout à fait. D'abord, il importe de souligner que si le principe de l'expérience fonctionne en laboratoire, on est encore loin de pouvoir l'appliquer à de véritables patients. Ensuite, il faut préciser que les résultats de l'équipe française, si remarquables soient-ils, ne sont que le prolongement logique d'un ensemble de recherches dont les premières étapes remontent aux années 1950. L'histoire de ces recherches est exposée dans un article assez technique paru en 2010 dans la revue Genes & Development (24:2239-2263), qui publie aussi les travaux des chercheurs français. Retraçons les grandes lignes de cette aventure scientifique qui a révolutionné la biologie.
Agrandissement : Illustration 2
En 1953, Le Britannique Francis Crick et l'Américain James Watson découvrent la structure en double hélice de l'ADN, ouvrant la voie à la génétique moléculaire contemporaine. L'essor de la biologie moléculaire va influencer très fortement la conception des scientifiques relative à l'une des plus grandes énigmes du monde vivant : celle du développement. Comment se développe un embryon ? Comment, à partir d'une seule cellule initiale, l'œuf fécondé, se forment les quelque 350 types de cellules différentes qui façonneront l'organisme d'un mammifère ou d'un oiseau?
Pour les biologistes, l'œuf fécondé, résultant de la fusion du spermatozoïde et de l'ovule, est «totipotent», c'est-à-dire qu'il possède la capacité virtuelle de se transformer en n'importe quelle cellule de l'organisme achevé. Dans les premiers jours qui suivent la fécondation, l'œuf se divise en deux, puis en quatre, en huit, en seize et aoinsi de suite jusqu'à former un «blastocyste», une masse de cellules encore indifférenciées, et qui sont encore totipotentes. Au cours des étapes suivantes, les cellules se différencient progressivement, pour former le tissu nerveux, les muscles, le sang, la moelle, les os, les différents organes. Plus le développement progresse et moins les cellules ont de possibilités de devenirs différents. Au terme du processus, elles sont devenues spécialisées : le foie ne produit plusque du foie, le muscle du muscle, et ainsi de suite.
Mais quel mécanisme dirige le développement et oriente chaque lignée cellulaire vers son destin ultime ? La conception qui s'est forgée avec l'essor de la biologie moléculaire est qu'un «programme génétique» gouverne l'ensemble du processus. Ce programme est propre à l'espèce, il diffère par exemple pour l'homme et la souris, et il est codé dans l'ADN. Chaque cellule de l'embryon ayant le même ADN, toutes les cellules ont au départ les mêmes possibilités. L'idée générale est qu'au cours des différentes étapes du développement, une partie des gènes d'une lignée cellulaire donnée deviennent silencieux tandis que d'autres s'expriment. Les gènes fonctionnent en quelque sorte comme des commutateurs qui aiguillent les cellules dans différentes directions de développement, jusqu'à aboutir à une spécialisation complète. A l'arrivée, une cellule du foie n'exprimera que les gènes actifs dans le foie, et idem pour le cœur, les poumons, les muscles, etc.
Le programme codé dans l'ADN règle donc l'ensemble des milliards de divisions cellulaires nécessaires pour façonner l'organisme. Cette théorie comporte quelques lacunes. En particulier elle n'explique pas comment, au début du développement, les cellules commencent à se différencier : qu'est-ce qui fait que certains commutateurs génétiques sont actionnés et d'autres non ? Pour compléter la théorie du programme génétique, il faut ajouter des facteurs « épigénétiques » : par exemple, le fait qu'une cellue se trouve à la surface extérieure du blastocyste plutôt qu'à l'intérieur peut influer sur les premiers «aiguillages» de son développement. Mais le cadre général de la théorie est clair : les cellules sont aiguillés en fonction du génome de l'espèce et, une fois qu'elles ont suivi leur voie de développement, le processus est irréversible. Ce développement s'effectue par une succession de choix qui conduit chaque type de cellule à remplir une fonction précise. L'irréversibilité du processus garantit que les structures de l'organisme sont stables : si le foie se mettait soudain à se transformer en os, ce serait assez gênant.
Mais dès les années 1950, les biologistes ont observé que la loi du développement irréversible souffrait des exceptions. Robert Briggs, Thomas King puis John Gurdon ont réalisé des expériences de clonage sur des batraciens qui démontraient que dans certains cas, les gènes «éteints» au cours du développement peuvent se rallumer. Dans ces manips, le noyau d'une cellule différenciée est introduit dans le cytoplasme d'un œuf lui-même privé de son noyau. Or, l'œuf ainsi reconstruit peut se comporter comme un œuf fécondé naturellement, et donner naissance à un organisme entier.

Agrandissement : Illustration 3

C'est exactement la même expérience, transposée chez les mammifères, qu'ont réussi en 1996-97 les Ecossais Ian Wilmut et Keith Capmpbell, «pères» conceptuels de la brebis Dolly. L'embryon qui a donné naissance à Dolly n'était pas issu de la fécondation naturelle d'un ovule par un spermatozoïde. Il était reconstruit à partir d'un ovule non fécondé, et énucléé - donc privé de son matériel génétique ; dans cet ovule sans noyau, Wilmut et ses collègues ont introduit le noyau d'une cellule différenciée, en l'occurrence une cellule de glande mammaire provenant d'une brebis finn dorset de six ans (d'après Wilmut, le nom de Dolly est un hommage à la chanteuse country Dolly Parton, heureuse propriétaire d'un imposante paire de glandes mammaires).
Le résultat révolutionnaire obtenu par Wilmut et ses collègues, c'est qu'au lieu de se diviser pour produire de nouvelles cellules de glandes mammaires, l'œuf qu'ils ont reconstruit a donné naissance à une brebis entière, et bien vivante. Autrement dit, le noyau de cellule mammaire introduit dans l'ovule a échappé à son destin génétique et a été «reprogrammé» pour se comporter comme le noyau d'un œuf fécondé normal.
Cette première a été suivie de dizaines d'autres clonages réussis de vaches, cochons, chevaux, chats, etc. L'onde de choc Dolly a renversé une fois pour toutes le dogme de l'irréversibilité du développement, tout en ouvrant la voie à une «médecine régénératrice» fondée sur le concept de reprogrammation cellulaire : l'idée est de transformer une cellule en une autre, ce qui pourrait permettre de réparer ou de reconstituer un tissu ou un organe abîmés. En quelque sorte, l'équivalent d'une greffe, mais à l'échelle de la cellule.
C'est l'enjeu des recherches sur les cellules souches, qui ont démarré sur la lancée du clonage de Dolly. Les premières cellules souches auxquelles on s'est intéressé sont celles de l'embryon précoce, qui sont, comme on l'a vu plus haut, totipotentes. Fin 1998, deux équipes américaines, celles de James Thomson à l'université du Wisconsin et celle de John Gearhart à l'université Johns Hopkins, annonçaient qu'elles avaient réussi à cultiver des cellules souches embryonnaires humaines. La nouvelle n'a pas fait autant de bruit que le clonage de Dolly, mais ses conséquences sont majeures : en culture, les cellules souches de l'embryon se reproduisent à l'infini en consezrvant leur totipotence. Ainsi, une seule lignée issue d'un embryon pourrait, en théorie, fourni une source virtuellement inépuisable de pièces de rechange pour l'organisme. Le «clonage thérapeutique» repose sur un concept similaire : il s'agit de reproduire le transfert de noyau cellulaire qui a fait naître Dolly, non pour obtenir un nouvel animal, mais pour produire un tissu cellulaire particulier.
Ces deux approches, jugées très prometteuses au début des années 2000, se sont cependant heurtées à de nombreuses difficultés, en particulier pour des raisons éthiques. C'est pourquoi, depuis une décennie, les biologistes ont cherché activement à s'affranchir de l'embryon et du clonage. C'est dans ce contexte que Shinya Yamanaka, de l'université de Kyoto, a tenté à partir de 2003 de reprogrammer des cellules adultes différenciées, qui ne sont pas naturellement totipotentes.
Yamanaka et son collègue Kazutoshi Takahashi ont identifié des gènes régulateurs susceptibles de modifier le programme génétique des cellules. En 2007, ils sont parvenus à un premier résultat important. Ils ont introduit dans des cellules adultes quatre gènes qui ne s'expriment normalement qu'au stade embryonnaire. Ainsi traitées, les cellules ont acquis des propriétés similaires à celles des celluels souches de l'embryon : sans être exactement totipotentes, elles sont devenues «pluripotentes», c'est-à-dire qu'elles peuvent donner naissance à presque tous les tissus. Parallèlement, James Thomson, déjà cité, a obtenu un résultat similaire.
Depuis 2007, les recherches sur ces «cellules pluripotentes induites» ont rapidement progressé. Leur potentiel thérapeutique est énorme : elles pourraient permettre de transformer en réalité la médecine régénératrice dont rêvent les biologistes depuis Dolly ; elles pourraient aussi permettrent de modéliser des maladies à l'échelle cellulaire de façon à étudier de nouveaux traitements. Ces perspectives se heurtent encore à d'importantes difficultés techniques. Le processus de reprogrammation des cellules n'est pas anodin, et les cellules pluripotentes induites ont tendance à produire des tumeurs. Le fait d'introduire des gènes qui ne sont pas présents naturellement entraîne des risques dont on n'a pas encore réussi à s'affranchir. Mais les biologistes ont cependant d'immenses espoirs, même s'il faudra sans doute de longues années avant de faire aboutir ces travaux de laboratoire dans le domaine de la clinique.
Il faut ajouter que sur le plan de la biologie fondamentale, la reprogrammation des cellules ouvre un champ de recherche passionnant, qui pourrait notamment permettre de mieux comprendre les mécanismes qui conduisent au cancer. Dans ce paysage, les travaux de l'équipe de Jean-Marc Lemaître introduisent un développement supplémentaire. En effet, jusqu'ici, on n'avait pas réussi à reprogrammer les cellules sénescentes. Lemaître et ses collègues ont utilisé la combinaison de quatre gènes déjà mise au point par Yamanaka, mais ils ont ajouté deux autres facteurs génétiques pour contourner l'obstacle de la sénescence. On pourrait ainsi soigner un patient atteint d'une maladie du vieillissement en utilisant les propres cellules de ce patient, et donc s'affranchir des mécanismes de rejet immunitaire.
Les «cellules de Jouvence» des biologistes actuels donnent corps à l'utopie formulée par le philosophe britannique Francis Bacon au XVIème siècle : celle d'une maîtrise de la nature permettant de prolonger la vie et de guérir les maladies. L'horizon de l'utopie est désormais celui du laboratoire. L'avenir dira s'il est illusoire ou bien réel.


