Si les anticorps sont essentiels dans la protection contre l’infection par les virus, nos connaissances de l’immunité anti-virale suggèrent que ce ne sont pas eux mais certains globules blancs, les lymphocytes T cytotoxiques*, qui permettent d’éradiquer une virose installée – et empêcher les formes sévères.
L’immunité s’appuie sur un système complexe qui s’est élaboré au cours de l’évolution des espèces, avec de multiples effecteurs** distincts intervenant de façon successive et complémentaire à partir de la rencontre de notre organisme avec un virus. Pour schématiser, on peut distinguer trois niveaux dans ce système de défense :
- Les barrières naturelles, constituées par les structures protectrices de la peau, des muqueuses et de leurs sécrétions (dans le nez, la gorge, les bronches et les poumons par exemple), mais aussi par certaines réactions aux corps étrangers (toux et éternuements, expectorations, etc.). Le port d’un masque est une façon de renforcer les barrières naturelles.
- L’immunité innée (ou "non-spécifique") qui s’appuie sur un ensemble de cellules et de molécules capables de reconnaître des éléments dangereux et déclencher des réactions de défense. Contre les virus, notre organisme met en jeu d’une part des cellules qui éliminent des particules virales (« macrophages » principalement), mais aussi d’autres (cellules « tueuses naturelles » ou « NK ») qui reconnaissent et tuent nos propres cellules lorsqu’elles sont le siège de la multiplication de virus.
- L’immunité adaptative (ou "spécifique"), qui permet à notre organisme d’élaborer des défenses ciblant spécifiquement certaines structures virales, que l’on appelle "antigènes". Comme l’indique son nom, cette immunité s’adapte à chaque pathogène rencontré. Il lui faut quelques jours pour se mette en place et elle intervient donc plus tard que l’immunité innée.
C’est sur l’immunité adaptative que nous allons insister pour deux raisons : d’une part son action, bien que déclenchée plus tard, est indispensable à l’éradication du virus, et, d’autre part, elle est le support de la mémoire immunitaire, assurant la protection ultérieure.
L’échappement*** immunitaire des virus, tel que nous l’observons dans l’épidémie actuelle avec la sélection de « variants » du Sars-Cov-2, est principalement dû à la survenue de mutations, acquises au cours de leur multiplication, qui leur permettent de ne plus être reconnus par certains effecteurs de l’immunité adaptative. Notons que les mutations surviennent au hasard avec une probabilité constante à chaque réplication du virus ; par conséquent, plus un virus se multiplie dans les cellules d’un individu d’une part, et plus il est répandu au sein d’une population d’autre part, plus le risque de mutation et donc d’apparition d’un variant est élevé. C’est donc en empêchant la propagation du virus qu’on peut limiter le risque d’émergence de variants.
Mais il convient d’abord de préciser la nature des réponses mises en jeu et leurs rôles respectifs. Par souci didactique nous n’évoquerons que les agents « effecteurs » (qui agissent directement sur le virus), sans remonter aux mécanismes de leur mise en place –et en particulier l’aide qu’ils reçoivent de certaines autres cellules pourtant essentielles (cellules dendritiques, puis lymphocytes T auxiliaires, ..).
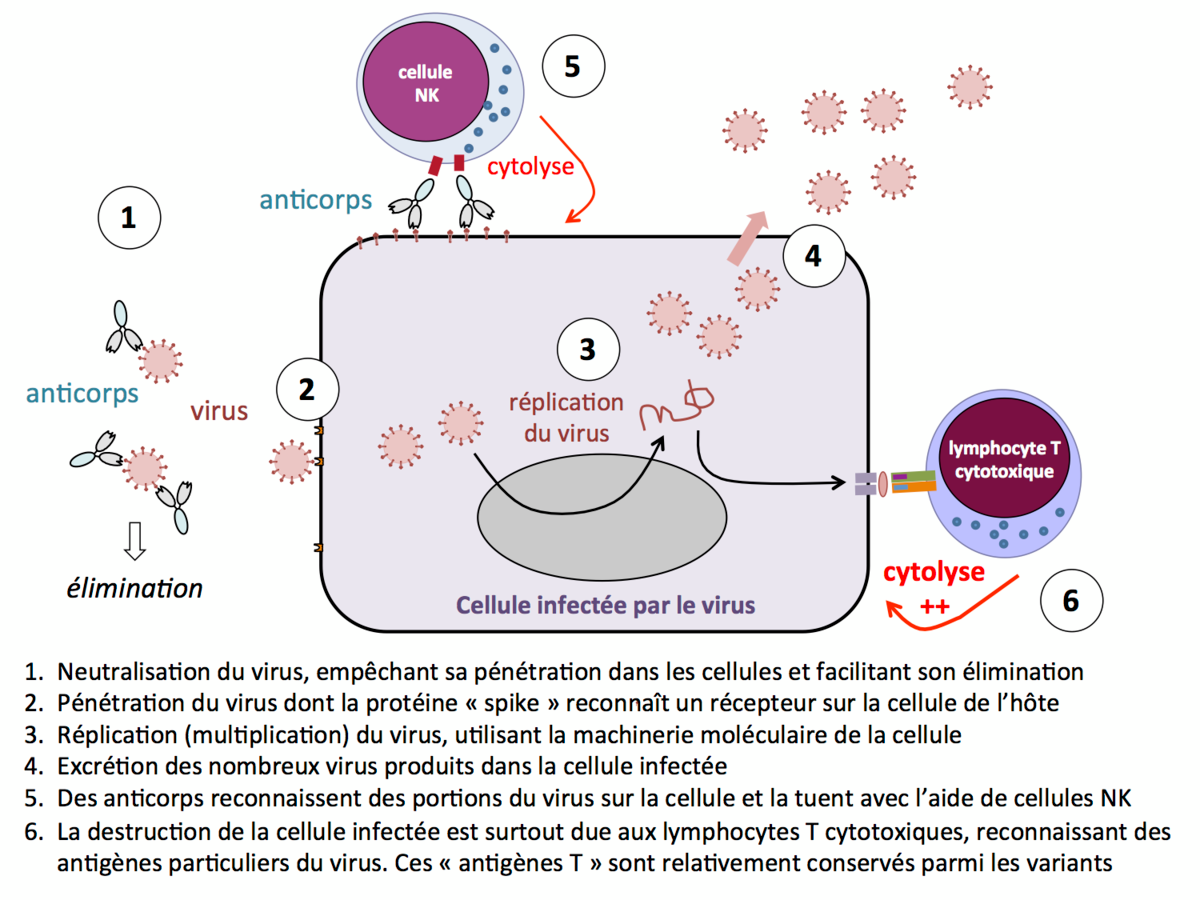
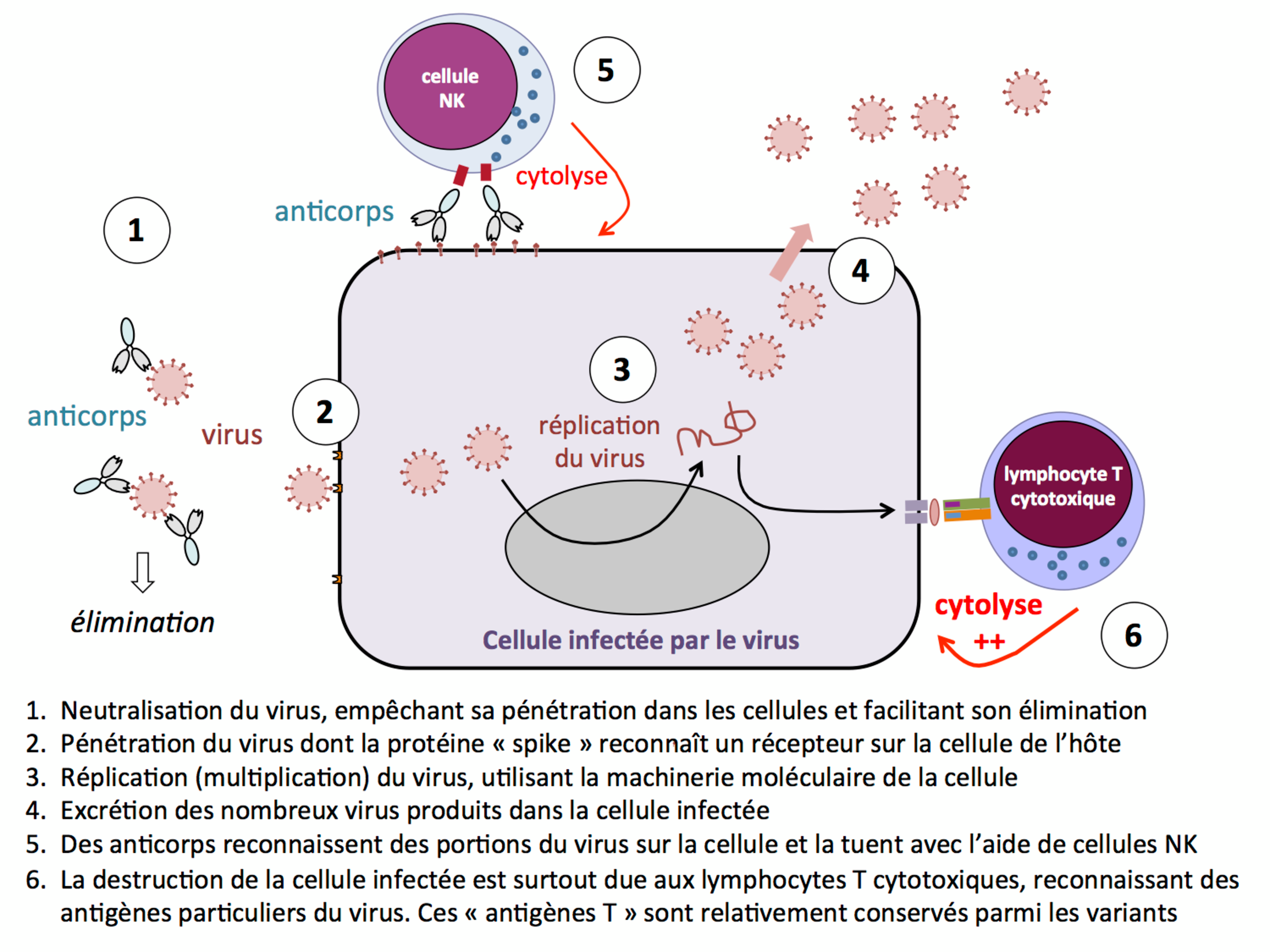
Les réponses immunitaires adaptatives contre les virus mettent en jeu deux catégories d’agents effecteurs : les anticorps et les lymphocytes T cytotoxiques (voir figure).
- Rôles des anticorps :
Ils sont surtout protecteurs : les anticorps neutralisent le virus en bloquant des parties impliquées dans le contact et la pénétration dans nos cellules. Les particules virales ainsi recouvertes d’anticorps ne peuvent plus se fixer à la membrane de nos cellules et sont ensuite plus facilement éliminées par des macrophages.
Nos anticorps protecteurs reconnaissent essentiellement des antigènes du virus situés à sa surface, tels que la protéine « spike » du SarsCov-2. Un des mécanismes classiques d’échappement du virus à l’immunité est lié aux mutations qui surviennent lors de la multiplication du virus dans notre organisme. Cet échappement concerne très principalement cette protéine spike : les formes mutées ne sont plus (ou sont moins bien) reconnues par les anticorps, ce qui donne aux virus un avantage sélectif : ainsi apparaissent les variants que nous connaissons. Les rappels de vaccination (et particulièrement la 3ème dose) compensent en partie cet échappement immunitaire en augmentant l’affinité des anticorps neutralisants (voir par ex. pour le variant omicron Garcia-Beltran et al, Cell 2022 ; Planas et al, Nature 2022).
Lors d’une virose, c’est-à-dire d’une infection virale installée, les anticorps n’ont que peu d’effet et c’est l’immunité cellulaire, liée en particulier aux lymphocytes T cytotoxiques, qui devient l’axe déterminant de la réponse immunitaire (voir ci-dessous). Le rôle des anticorps n’est cependant pas nul : ils freinent la propagation des particules virales en les neutralisant, et d’autre part ils peuvent tuer des cellules infectées par un processus appelé « cytotoxicité cellulaire dépendante des anticorps » (ADCC) au cours duquel il sont aidés par des cellules de l’immunité innée, les « cellules NK ».
- Rôle des lymphocytes T cytotoxiques :
Pour se multiplier, tous les virus ont besoin d’infecter une cellule-hôte et d’utiliser la machinerie cellulaire pour répliquer leurs propres composants et former de nouveaux exemplaires du virus. Lorsque le virus fait produire ses propres composants à la cellule-hôte, certains fragments de protéines virales se trouvent exposés à la surface de la cellule infectée. Ces fragments sont des antigènes qui vont permettre aux lymphocytes T cytotoxiques de reconnaître qu’une cellule est infectée, et de déclencher des mécanismes de cytolyse, c’est à dire aboutissant à la mort de la cellule infectée (voir figure). Ce processus est habituellement nécessaire à l’éradication d’une infection virale.
Les lymphocytes T cytotoxiques ne savent pas reconnaître le virus entier à l’extérieur des cellules, ni avant sa pénétration dans les cellules, ni après sa libération. Ils n’ont donc pas à proprement parler une fonction préventive de l’infection. Mais ils sont essentiels pour maîtriser la maladie virale une fois déclarée, et l’on peut raisonnablement penser que leur rôle est déterminant pour empêcher l’aggravation.
Agrandissement : Illustration 1
Plusieurs études ont montré que, dans le cas du Sars-Cov-2, les antigènes reconnus par les lymphocytes T cytotoxiques diffèrent globalement très peu entre les variants (voir par ex. Geers et al, Sci Immunol 2021). L’échappement immunitaire concerne surtout les antigènes de la protéine spike reconnus par les anticorps, mais pas ou peu ceux reconnus par les lymphocytes T cytotoxiques. Ceci amène une hypothèse : les variants apparus récemment sont mal neutralisés par les anticorps induits par l’immunisation vaccinale ou naturelle avec la souche initiale (variant « alpha »), mais restent relativement bien contrôlés par les lymphocytes T, expliquant la faible fréquence des formes graves. Ainsi, il apparaît clairement que tous les vaccins, s’ils ne protègent plus que partiellement de l’infection par les nouveaux variants, restent très efficaces pour éviter l’aggravation de la Covid19.
Des chercheurs ont même pu montrer qu’un facteur de protection contre des formes graves de Covid19 pourrait être des contacts préalables, même anciens, avec d’autres coronavirus avec lesquels les Sars-Cov-2 partageraient des antigènes reconnus par des lymphocytes T (Grifoni et al, Cell 2020).
Pierre Aucouturier, professeur d’immunologie, faculté de médecine Sorbonne Université, Paris.
Yannick Chantran, responsable du Département d’Immunologie Biologique, hôpitaux Saint-Antoine / Tenon / Trousseau, Paris.
Notes :
* Les lymphocytes T cytotoxiques (ou « CTL ») ont pour fonction de tuer les cellules qu’ils reconnaissent comme dangereuses – ici, celles de nos cellules qui sont le siège de la multiplication de virus.
** On appelle « effecteurs » les cellules ou les molécules qui agissent directement sur les cibles (antigènes) reconnues par le système immunitaire, pour les neutraliser ou les éliminer.
*** Par « échappement » on entend tous les mécanismes que met en jeu le virus pour ne plus être reconnu par le système immunitaire de l’hôte.
Références :
Garcia-Beltran WF, St Denis KJ, Hoelzemer A, Lam EC, Nitido AD, Sheehan ML, Berrios C, Ofoman O, Chang CC, Hauser BM, Feldman J, Roederer AL, Gregory DJ, Poznansky MC, Schmidt AG, Iafrate AJ, Naranbhai V, Balazs AB. mRNA-based COVID-19 vaccine boosters induce neutralizing immunity against SARS-CoV-2 Omicron variant. Cell. 2022 Jan 6:S0092-8674(21)01496-3. doi: 10.1016/j.cell.2021.12.033.
Planas D, Saunders N, Maes P, Guivel-Benhassine F, Planchais C, Buchrieser J, Bolland WH, Porrot F, Staropoli I, Lemoine F, Péré H, Veyer D, Puech J, Rodary J, Baele G, Dellicour S, Raymenants J, Gorissen S, Geenen C, Vanmechelen B, Wawina-Bokalanga T, Martí-Carreras J, Cuypers L, Sève A, Hocqueloux L, Prazuck T, Rey F, Simon-Loriere E, Bruel T, Mouquet H, André E, Schwartz O. Considerable escape of SARS-CoV-2 Omicron to antibody neutralization. Nature. 2021 Dec 23. doi: 10.1038/s41586-021-04389-z.
Geers D, Shamier MC, Bogers S, den Hartog G, Gommers L, Nieuwkoop NN, Schmitz KS, Rijsbergen LC, van Osch JAT, Dijkhuizen E, Smits G, Comvalius A, van Mourik D, Caniels TG, van Gils MJ, Sanders RW, Oude Munnink BB, Molenkamp R, de Jager HJ, Haagmans BL, de Swart RL, Koopmans MPG, van Binnendijk RS, de Vries RD, GeurtsvanKessel CH. SARS-CoV-2 variants of concern partially escape humoral but not T-cell responses in COVID-19 convalescent donors and vaccinees. Sci Immunol. 2021 May 25;6(59):eabj1750. doi: 10.1126/sciimmunol.abj1750.
Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Dan JM, Moderbacher CR, Rawlings SA, Sutherland A, Premkumar L, Jadi RS, Marrama D, de Silva AM, Frazier A, Carlin AF, Greenbaum JA, Peters B, Krammer F, Smith DM, Crotty S, Sette A. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell. 2020 Jun 25;181(7):1489-1501.e15. doi: 10.1016/j.cell.2020.05.015.



