sfari.org Traduction de "SFARI | The need for objective outcome measures to advance intervention research in autism"

Agrandissement : Illustration 1

SFARI | Le besoin de mesures objectives des résultats pour faire progresser la recherche interventionnelle en autisme
|
Par Paul Wang - 17 décembre 2019
La littérature sur l'intervention en autisme est remplie d'essais statistiquement non significatifs, tant pour les approches pharmacologiques que comportementales-éducatives. Bien que les sujets des essais de médicaments ouverts montrent plus souvent que les autres une amélioration, tout comme les sujets des essais d'intervention comportementale non contrôlés et " contrôlés par liste d'attente ", il a été décevant de constater les avantages associés au traitement dans les essais qui comprennent des groupes de comparaison bien contrôlés.
Mais lorsqu'un essai de traitement donne des résultats non significatifs, nous devons nous demander si l'essai était vraiment " négatif " ou si l'essai lui-même a " échoué ". Dans le langage du développement de médicaments (et applicable également à d'autres approches d'intervention), les essais négatifs sont ceux qui fournissent des preuves valables du manque d'efficacité du traitement, au moins dans la population et dans les conditions dans lesquelles il a été testé. En revanche, les essais qui échouent sont ceux qui, en raison de lacunes dans la conception ou l'exécution, ne permettent pas de tirer des conclusions valables sur l'efficacité du traitement.
Les essais de médicaments pour l'autisme donnent souvent lieu à d'importantes réponses placebo, et leur nombre suggère que ces essais sont très probablement des essais qui ont échoué, plutôt que des essais rigoureusement négatifs. Beaucoup avaient espéré que les échelles de symptômes de l'autisme évaluées par les parents seraient moins sensibles aux effets du placebo que la symptomatologie autodéclarée dans les cas de dépression, d'anxiété et d'autres troubles psychiatriques, mais cela ne s'est pas avéré vrai.
Les essais d'une gamme variée de médicaments chez les enfants et les adultes TSA ont montré que les améliorations associées au placebo étaient aussi importantes que celles des groupes de traitement. Un essai récemment publié sur l'efficacité de la mémantine (un antagoniste des récepteurs NMDA) a montré de tels effets sur l'échelle de réponse sociale (SRS) dans le contexte d'un plan de suppression randomisée 1 - un plan d'essai qui est considéré comme moins susceptible aux effets du placebo que le plan prospectif commun à groupes parallèles qui est randomisé au départ. Les essais infructueux sur les antagonistes des récepteurs métabotropes du glutamate 5 (mGluR5) du groupe I2,3 et l'arbaclofène (un agoniste des récepteurs GABAB)4 dans le syndrome de l' X fragile ont également utilisé des échelles de symptômes évaluées par les parents et ont également montré des effets importants du placebo (figure 1).

Agrandissement : Illustration 2
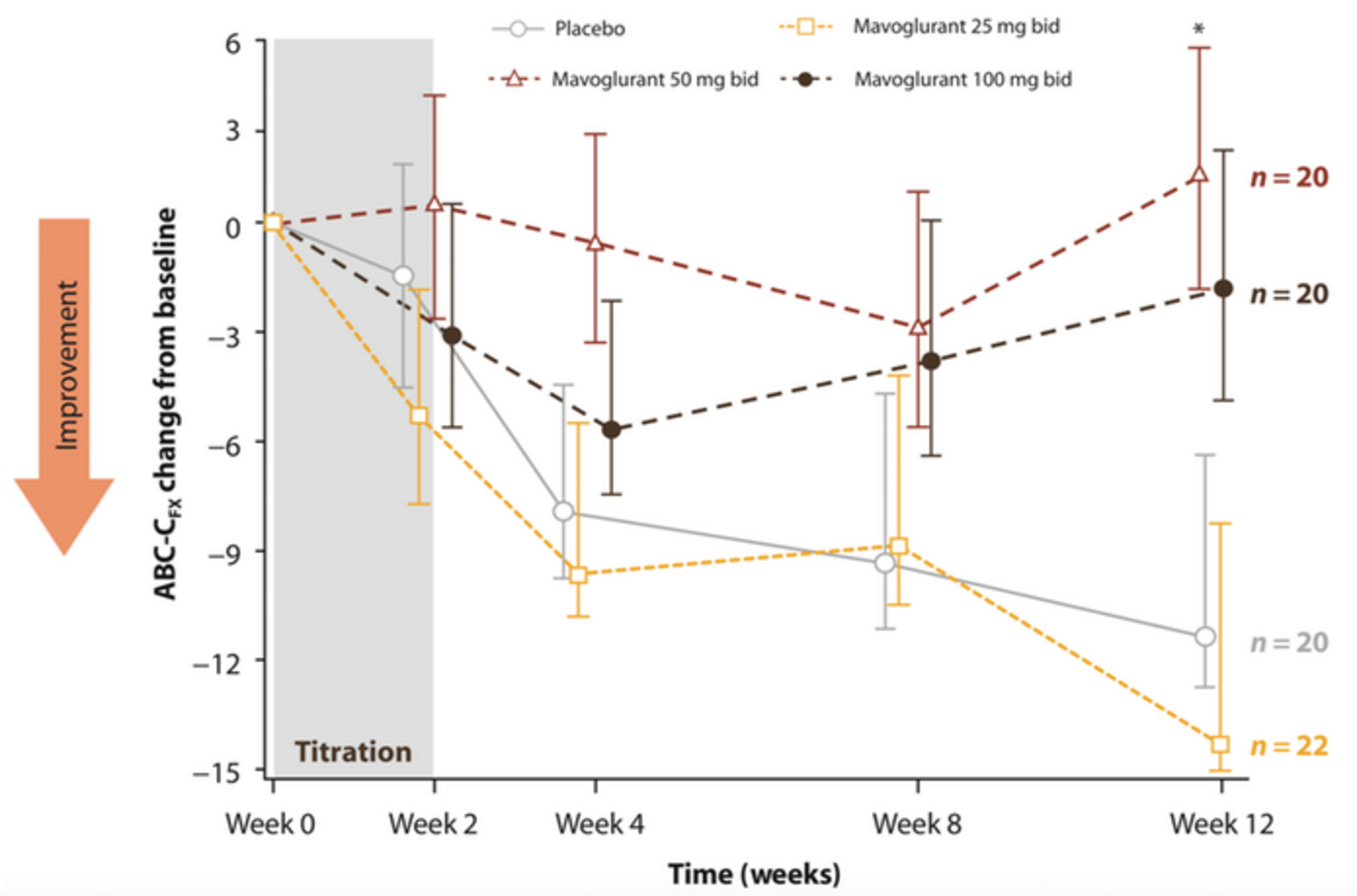
Peut-être que les médicaments qui ont été testés ne fonctionnent pas vraiment mieux que le placebo, et les résultats statistiquement non significatifs reflètent l'absence de tout avantage réel. Mais même pour un médicament (futur) qui est vraiment bénéfique, les changements liés au placebo ajouteraient au défi de démontrer les avantages associés au traitement.
On croit que les causes de ces effets placebo sont multiples, et divers plans d'étude de substitution (allant des périodes de démarrage des placebos au plan de retrait randomisé) ont été mis en œuvre dans des essais de médicaments pour d'autres affections psychiatriques afin de minimiser les effets placebo, mais sans succès complet (p. ex., 5).
D'autres effets non spécifiques influencent les échelles d'évaluation subjectives
Rebecca Jones et ses collègues ont récemment signalé que les problèmes des échelles d'évaluation actuelles de l'autisme s'étendent au-delà du placebo. Ils ont constaté que les évaluations en série (au départ et huit semaines plus tard) sur l'échelle SRS et sur la liste de contrôle des comportements aberrants (ABC) montraient une amélioration en l'absence de tout traitement 6 (figure 2). Ces " améliorations " ne peuvent être qualifiées d'effets placebo, puisqu'aucun placebo n'a été administré. Elles représentent plutôt une catégorie plus large d'effets non spécifiques qui se rapportent probablement à de nombreuses échelles d'évaluation de l'autisme déclarées par les parents.
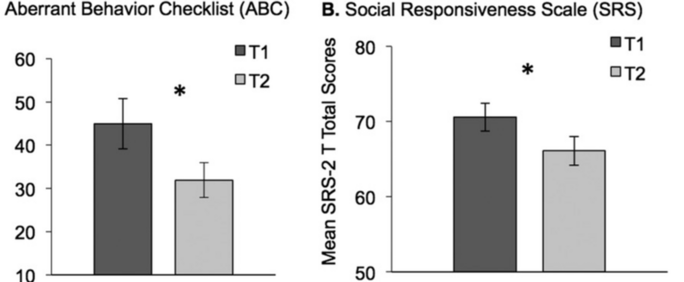
Agrandissement : Illustration 3
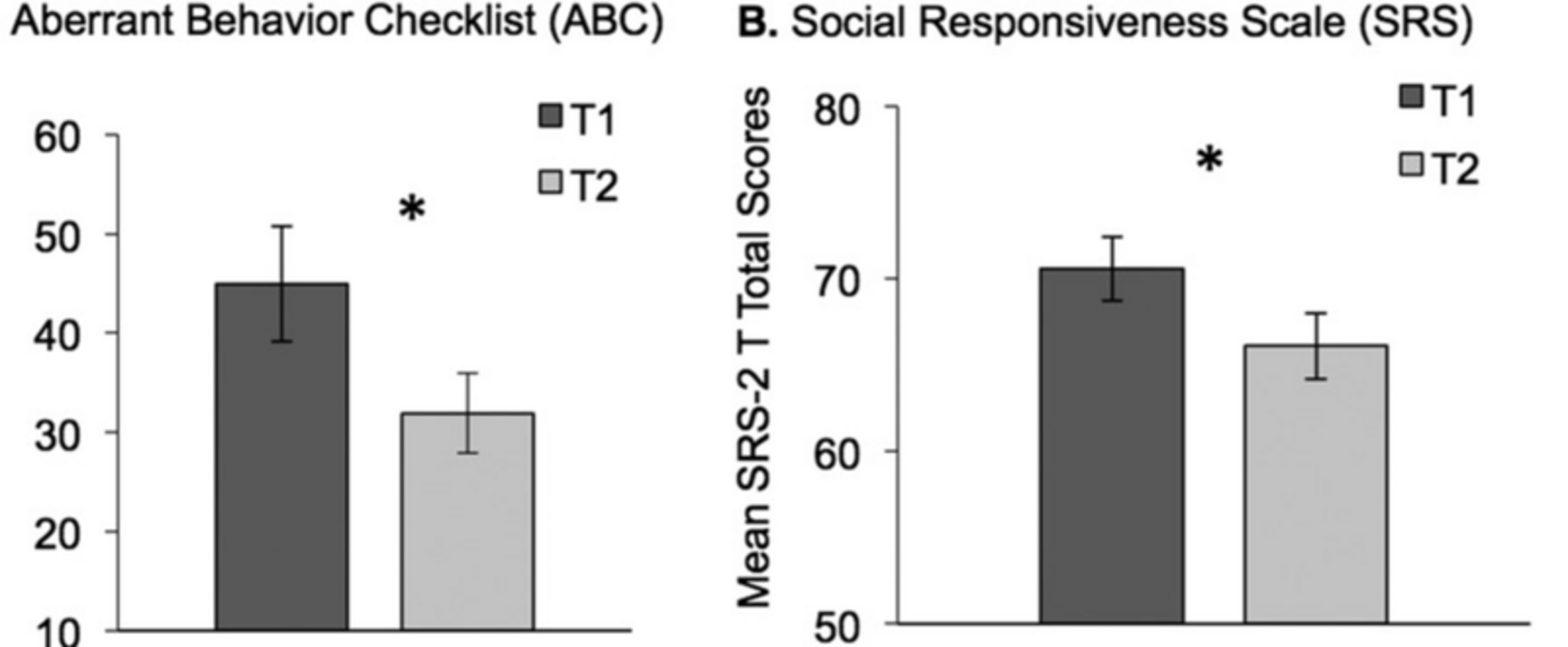
Comme le SRS et l'ABC, la plupart des évaluations de la sévérité des symptômes de l'autisme sont des échelles d'évaluation déclarées par les parents. À ce titre, elles sont intrinsèquement subjectives et sujettes à des effets non spécifiques. Les échelles évaluées par les cliniciens, comme les échelles d'impression globale clinique, sont également subjectives et peuvent montrer des effets placebo importants (p. ex., 7). (On constate un contraste frappant dans les mesures objectives utilisées dans les essais cliniques portant sur d'autres affections médicales, comme l'hémoglobine glycosylée pour les traitements du diabète ou la charge virale pour les traitements du virus de l'immunodéficience humaine [VIH]).
Les échelles de comportement adaptatif de Vineland (version entrevue) dépendent également des rapports des parents, mais ces rapports sont filtrés par un clinicien et sont ancrés dans des comportements spécifiques plutôt que d'être de vagues évaluations de la sociabilité. De nombreux chercheurs craignent que les échelles de Vineland ne soient pas sensibles à des changements faibles mais significatifs de la gravité des symptômes, mais elles ont montré une résistance relative aux effets du placebo et ont également montré le potentiel de changement dans au moins quelques essais (p. ex., 8, 9). Par conséquent, il a été désigné comme le principal critère d'évaluation de plusieurs essais en cours très médiatisés sur l'autisme (p. ex., balovaptan [un antagoniste du récepteur de la vasopressine V1A ; NCT03504917 et NCT02901431] et arbaclofène [NCT03887676 et NCT03682978]).
L'Autism Diagnostic Observation Schedule (ADOS), évidemment conçu comme une échelle diagnostique, a également été utilisé comme mesure des résultats dans les essais d'intervention (p. ex., 10). Sa notation est fortement ancrée dans des actions et des comportements spécifiques, mais elle conserve un certain degré de subjectivité, puisqu'elle est notée par des cliniciens (formés et certifiés). Comme on pouvait s'y attendre compte tenu de ses racines diagnostiques, l'ADOS est toutefois relativement insensible au changement. Il exige également beaucoup de ressources, et son administration et sa notation demandent beaucoup de temps et d'efforts. Ni le Vineland ni l'ADOS ne conviennent à une administration répétée dans de courts intervalles de temps, comme il serait souhaitable dans une étude qui cherche à élucider la trajectoire du changement associé au traitement.
La mesure de l'impact de l'autisme (AIM) 11 , récemment mise au point, est toujours un rapport de parents, mais elle peut être administrée de façon répétée à des intervalles relativement courts et, comme la Vineland, elle est ancrée dans des comportements spécifiques. Son rendement comme mesure des résultats est évalué dans le cadre de plusieurs essais en cours (p. ex., arbaclofène [NCT03887676 et NCT03682978]).
Biomarqueurs physiologiques pertinents pour l'autisme
Des évaluations objectives pertinentes à l'autisme sont disponibles sous forme de biomarqueurs physiologiques, en utilisant des approches telles que la tomographie par émission de positrons (TEP), l'électroencéphalographie (EEG)/les potentiels liés aux événements (ERP), l'imagerie par résonance magnétique fonctionnelle (IRMf) et le suivi oculaire.
Ces méthodes ont été utilisées dans la recherche sur l'autisme pour fournir des preuves de l'engagement de la cible, pour démontrer la preuve du mécanisme et, éventuellement, pour démontrer la preuve du concept. Cependant, ces mesures reflètent évidemment des processus biologiques internes (dans le cas de l'EEG ou de l'IRMf) ou des comportements plutôt étroits dans un paradigme artificiel, basé sur le laboratoire (suivi oculaire), plutôt que des comportements et des fonctions de la vie réelle. Ainsi, bien qu'elles puissent fournir des preuves d'effets potentiellement pertinents des médicaments (p. ex. en association avec l'antagonisme du mGluR5 dans le syndrome de l' X fragile 12), elles ne peuvent servir de critères d'évaluation pour l'approbation réglementaire des médicaments et ne sont pas non plus entièrement satisfaisantes pour démontrer l'efficacité clinique des traitements comportementaux et éducatifs.
Subventions du SFARI pour soutenir l'élaboration de mesures de résultats fondées sur le comportement
Compte tenu de ces défis, l'Initiative de recherche sur l'autisme de la Fondation Simons (SFARI) a annoncé le lancement d'un appel de candidatures (AC) sur les nouvelles mesures des résultats dans les TSA - le premier AC sur ce sujet ciblé a été lancé en 2015 et le dernier en 2019.
Les subventions accordées dans le cadre de cet appel de candidatures visent à soutenir la mise au point de nouveaux outils d'évaluation qui pourraient servir de " critères d'évaluation acceptables " dans les essais réglementaires (ou servir à des fins analogues dans les essais comportementaux/éducatifs) tout en étant moins sujets à des effets non spécifiques et plus sensibles au changement que les mesures actuellement disponibles.
L'objectif de tous les projets subventionnés est d'élaborer des mesures fondées sur le comportement (c.-à-d. des évaluations directes du comportement du sujet, plutôt que des évaluations par les parents ou les cliniciens fondées sur le souvenir et l'interprétation du comportement des sujets). Ainsi, les mesures proposées dans ces projets évitent la subjectivité associée aux biais de mémoire, aux conditions non normalisées d'observation du comportement et à l'interprétation/notation par des évaluateurs non experts.
Quatre subventions ont été accordées en 2015. Un résumé des mesures qui ont été élaborées dans le cadre de ces projets se trouve ici.
Les nouvelles mesures (accordées à la suite de l'appel de candidatures de 2019) comprennent
- une mesure du regard qui promet d'être applicable à un large éventail d'âges et qui a déjà démontré son utilité comme mesure de la sévérité de l'autisme 13 (figure 3)
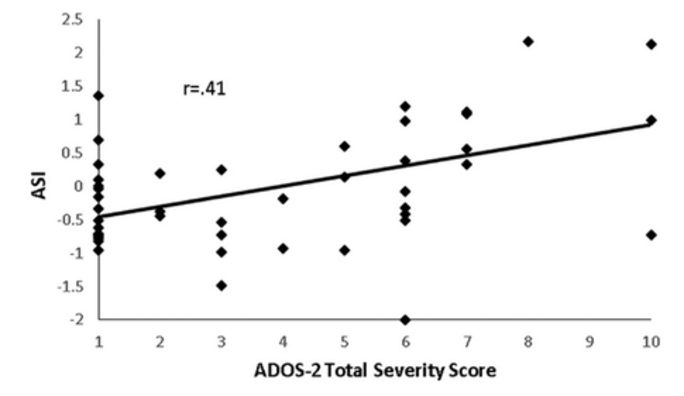
Figure 3. Relation entre la mesure de suivi oculaire et l'Autism Diagnostic Observation Schedule, 2e édition (ADOS-2). L'indice de sévérité de l'autisme (ASI), qui a été calculé à l'aide d'une mesure oculaire, est corrélé avec les scores de sévérité de l'autisme obtenus à partir de l'ADOS-2.
Chercheurs principaux (PI) : Stephen Kanne, Ph.D., Antonio Hardan, M.D. et Micah Mazurek, Ph.D. - Tests à base de tablettes des processus socio-perceptifs et socio-cognitifs
Les chercheurs principaux : Eva Loth, Ph.D. et Robert Leech, Ph.D. - une évaluation par ordinateur des comportements suscités lors de la présentation de stimuli socialement pertinents sur une tablette
PI : Guillermo Sapiro, Ph.D. - et le BOSCC (Brief Observation of Social Communication Change) 14 et l'ELSA (Elicitation of Language Samples for Analysis) - mesures qui suscitent des interactions socio-communicatives dans un cadre social normalisé (figure 4). Ces deux outils ont déjà été mis au point, mais ils doivent être affinés et validés.
PI : Helen Tager-Flusberg, Ph.D., Connie Kasari, Ph.D., So Hyun (Sophy) Kim, Ph.D., Catherine Lord, Ph.D. et Shrikanth Narayanan, Ph.D.
Figure 4. La brève observation du changement dans les communications sociales (BOSCC) rend compte de l'amélioration de la sociabilité. Le BOSCC a montré une diminution des scores de communication sociale (c.-à-d. indiquant une amélioration) après le traitement (T2) par rapport au niveau de référence (T1) lorsqu'il est appliqué à la fois aux vidéos des interactions parents/examinateurs/enfants (BOSCC standard) et aux vidéos montrant l'administration de l'Autism Diagnostic Observation Schedule, 2e
Chacun de ces projets examinera la validité psychométrique de leurs mesures, y compris la fiabilité test-retest et la fiabilité inter-juges, ainsi que la validité concurrente par rapport aux mesures existantes de la gravité des symptômes.
Le BOSCC et l'ELSA se distinguent des autres nouvelles mesures parce qu'ils évaluent le comportement social et communicatif dans le contexte d'une interaction " en direct " avec d'autres personnes, plutôt qu'à l'aide de stimuli informatiques ou de tablettes.
Les autres mesures pourraient bien être utiles comme paramètres de validation du concept ou comme marqueurs précoces des effets de l'intervention, mais elles sont confrontées à un plus grand défi que le BOSCC ou l'ELSA pour ce qui est de démontrer si elles indiquent une fonction dans des contextes sociaux réels et si elles sont donc appropriées comme " paramètres de validation ".
En faisant progresser la " science de la mesure " pour la symptomatologie de l'autisme, les nouvelles subventions ont le potentiel de faire avancer le développement du traitement à grande échelle. L'adoption de nouvelles mesures des résultats qui réduisent au minimum les effets du placebo et d'autres effets non spécifiques devrait diminuer le risque de résultats d'essais faussement négatifs et le rejet prématuré d'hypothèses thérapeutiques potentiellement valides qui en découle.
Les mesures élaborées et validées dans le cadre de cette nouvelle série de subventions ne constitueront certainement pas l'apogée de l'évaluation des résultats. Les technologies émergentes de collecte et d'analyse des données devraient en fin de compte permettre une véritable évaluation écologique de la symptomatologie - c'est-à-dire l'évaluation du comportement non pas pendant une période de temps précise dans un contexte expérimental, mais du comportement qui se produit tout au long de l'activité quotidienne et qui est évalué sur plusieurs heures de plusieurs jours. De telles méthodes soulèvent des questions de vie privée et potentiellement d'autres préoccupations avec lesquelles il faut composer, mais elles permettent d'évaluer exactement ce que les traitements de l'autisme devraient soutenir : des changements positifs dans les symptômes socio-communicatifs (et répétitifs-restrictifs et sensoriels) qui se manifestent tout au long de la journée dans des circonstances réelles.
Références
- Hardan A.Y. et al. Autism 23, 2096-2111 (2019) PubMed
- Berry-Kravis E. et al. Sci. Transl. Med. 8, 321ra5 (2016) PubMed
- Youssef E.A. et al. Neuropsychopharmacology 43, 503-512 (2018) PubMed
- Berry-Kravis E. et al. J. Neurodev. Disord. 9, 3 (2017) PubMed
- Fava M. et al. Psychother. Psychosom. 72, 115-127 (2003) PubMed
- Jones R.M. et al. Autism Res. 10, 1567-1572 (2017) PubMed
- Masi A. et al. Transl. Psychiatry 5, e640 (2015) PubMed
- Veenstra-VanderWeele J. et al. Neuropsychopharmacology 42, 1390-1398 (2017) PubMed
- Bolognani F. et al. Sci. Transl. Med. 11, eaat7838 (2019) PubMed
- Dawson G. et al. Pediatrics 125, e17-23 (2010) PubMed
- Kanne S.M. et al. J. Autism Dev. Disord. 44, 168-179 (2014) PubMed
- Hessl D. et al. PLoS One 14, e0209984 (2019) PubMed
- Frazier T.W. et al. J. Am. Acad. Child Adolesc. Psychiatry 57, 858-866 (2018) PubMed
- Grzadzinski R. et al. J. Autism Dev. Disord. 46, 2464-2479 (2016) PubMed
- Kim S.H. et al. Autism 23, 1176-1185 (2019) PubMed



