https://doi.org/10.53053/UGBV4448 Traduction de "Timing is key in treating sensory traits in fragile X" par Angie Voyles Askham / 11 juillet 2022
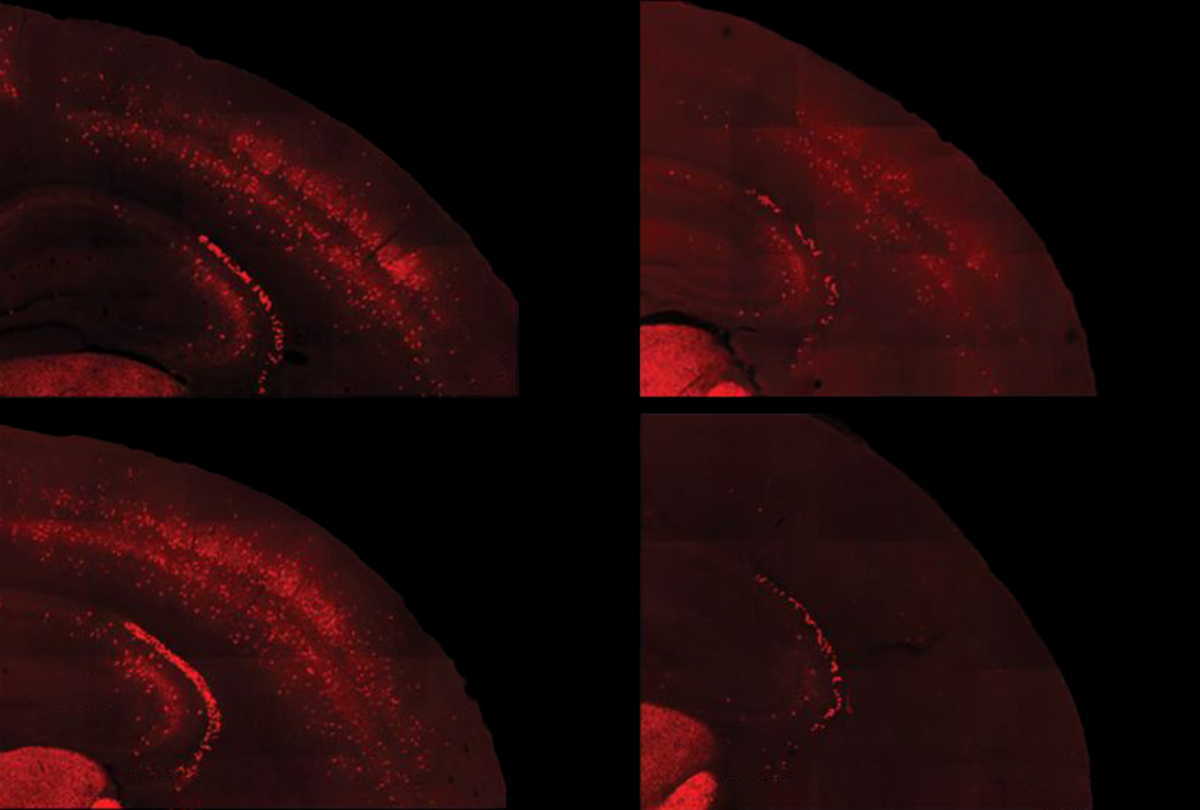
Agrandissement : Illustration 1
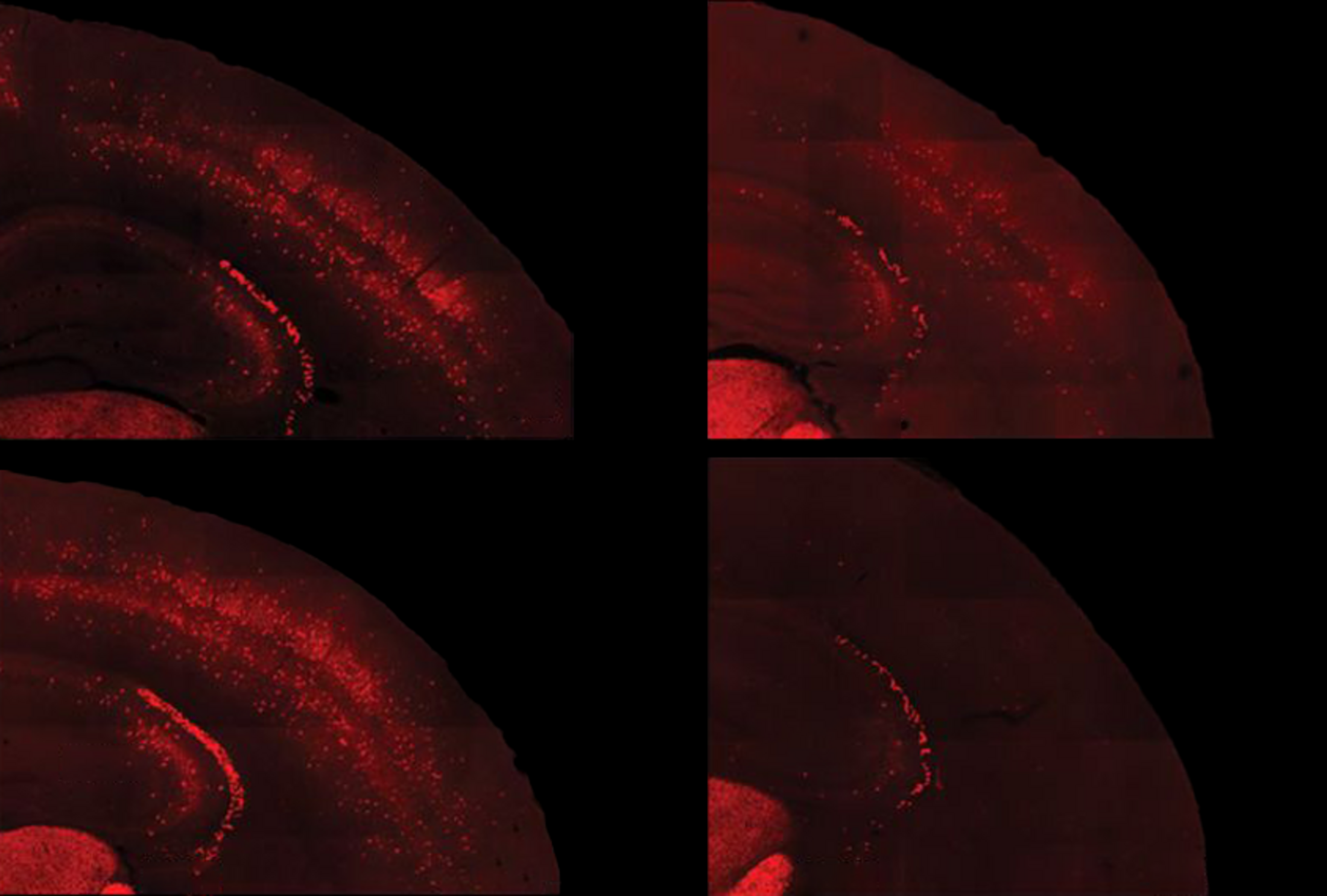
Un médicament expérimental stimule l'activité des neurones qui sont sous-développés dans le syndrome de l'X fragile et inverse les sensibilités sensorielles chez un modèle de souris de cette pathologie - mais seulement s'il est administré après la formation de certains circuits, selon une nouvelle étude non publiée. Les résultats révèlent une fenêtre potentielle pour le traitement des traits de l'X fragile et identifient un composé qui pourrait être pertinent pour les problèmes sensoriels de l'autisme, selon les chercheurs.
Les personnes atteintes du syndrome de l'X fragile - une affection liée à l'autisme causée par des mutations du gène FMR1 - présentent généralement une déficience intellectuelle et des sensibilités sensorielles. Ces sensibilités peuvent provenir d'une sous-activité des interneurones à parvalbumine (PV), un type de neurones inhibiteurs, selon des études menées sur des souris dépourvues du gène FMR1. Une étude de 2017 a révélé que ces neurones mûrissent aussi anormalement lentement chez les souris modèles de l'X fragile. Et certaines recherches suggèrent que les personnes autistes ont trop peu d'interneurones PV dans leur cortex, bien que ces résultats aient été contestés.
Dans la nouvelle étude, les chercheurs ont confirmé que les souris du modèle X fragile ont à la fois des neurones PV sous-actifs et pas assez nombreux, et ils ont lié ces changements à un excès d'interneurones PV qui meurent au cours de la deuxième semaine de vie, peu après avoir migré vers le cortex cérébral. Les chercheurs ont constaté que la correction de la sous-activité des cellules précurseurs des PV chez des souris âgées de 5 à 9 jours empêchait les cellules de mourir en masse par la suite, mais n'améliorait pas les réponses sensorielles des animaux.
"Cela nous a laissé très perplexes", a déclaré le chercheur principal Carlos Portera-Cailliau, professeur de neurologie et de neurobiologie à la David Geffen School of Medicine de l'université de Californie à Los Angeles.
En revanche, le traitement des animaux un peu plus tard dans leur vie - entre l'âge de 15 et 20 jours, lorsque les cellules PV commencent à former des connexions avec d'autres neurones - n'a pas empêché la mort des cellules, mais a inversé les réponses sensorielles atypiques des animaux, a constaté l'équipe. L'équipe a publié ses résultats sur un serveur de préimpression en mai.
Les travaux doivent encore faire l'objet d'un examen par les pairs et certaines questions demeurent, déclare Renata Batista-Brito, professeure adjointe de neurosciences et de génétique à l'Albert Einstein College of Medicine de New York, qui n'a pas participé aux travaux. D'abord, dit-elle, les cellules qui se développent en neurones PV donnent également naissance à un autre type d'interneurones, et il n'est pas clair si leur activité est également modulée. Mais en tant que première investigation, ces travaux sont "vraiment passionnants", déclare Mme Batista-Brito.
Le fait de tapoter le museau d'une souris typique active les neurones du cortex somatosensoriel de l'animal, la région du cerveau qui traite l'information tactile. Toutefois, après des stimulations répétées, les neurones s'adaptent et limitent leur activité.
Cependant, les souris du modèle de l'X fragile n'ont pas la même réponse adaptative, comme l'ont montré des recherches antérieures du laboratoire de Portera-Cailliau. "Elles ne réduisent pas progressivement leur activité pour s'adapter aux stimuli", explique Nazim Kourdougli, chercheur postdoctoral au sein du laboratoire.
Ce manque d'adaptation est dû à une déconnexion entre les neurones PV inhibiteurs et les neurones excitateurs avec lesquels ils forment un circuit, selon les nouveaux travaux. La stimulation optogénétique des cellules PV dans le cortex somatosensoriel de souris de type sauvage âgées de 10 jours a entraîné une diminution de l'activité des cellules excitatrices dans la région. Mais chez les souris du modèle X fragile, l'activation des cellules PV n'a eu aucun effet sur les neurones excitateurs, ce qui pourrait indiquer un retard de développement du circuit somatosensoriel.
Les chercheurs ont découvert qu'un médicament qui stimulait l'activité des cellules précurseurs des PV chez des souris âgées de 5 à 9 jours induisait un modèle plus typique d'expression génétique dans le cortex des animaux. Le traitement a également empêché les animaux de perdre des cellules PV, mais il n'a pas permis de réparer le circuit somatosensoriel ni d'améliorer la réponse adaptative des animaux au toucher d'une babine.
"Même si nous avons pu restaurer la densité [des cellules PV], cela n'a pas été suffisant pour aider le circuit", explique Portera-Cailliau, peut-être parce que le circuit n'était pas encore complètement formé.
Mais le fait de stimuler l'activité des cellules inhibitrices chez des souris âgées de 15 à 20 jours à l'aide d'un composé moléculaire différent, l'AG00563 - qui active un type de canal potassique essentiel à la fonction des interneurones PV - a eu l'effet inverse. Après 5 jours de traitement, les animaux avaient plus de cellules qui répondaient au stimulus et une réponse adaptative accrue.
Portera-Cailliau et ses collègues soupçonnent que, même si les animaux avaient déjà perdu une grande partie de leurs cellules PV, les cellules restantes étaient encore capables de se connecter correctement avec les cellules excitatrices pour former le circuit somatosensoriel.
"Je ne crois pas que nous compensions le manque de densité des cellules PV", déclare Kourdougli. Cependant, l'augmentation de l'activité des cellules PV d'une manière forte et spécifique "semble suffire à améliorer les déficits que nous avons étudiés."
Selon Eric Klann, directeur du Center for Neural Science de l'université de New York, à New York, qui n'a pas participé aux travaux, ces résultats soulignent l'importance de cartographier les trajectoires de développement des traits chez les souris modèles X fragile. "Déterminer à quel moment du développement les types de cellules ont une activité aberrante, puis les manipuler dans cette fenêtre est une façon très prometteuse d'aborder les choses."
Dans une étude publiée le mois dernier, Klann et ses collègues ont montré qu'un manque de FMRP, la protéine codée par FMR1, dans les interneurones PV contribue à d'autres traits liés à la fragilité X chez les souris, tels que des comportements sociaux atypiques et des comportements de type anxieux.
Ces travaux "confortent l'idée que ces interneurones pourraient être des cibles thérapeutiques", explique Mme Portera-Cailliau.
Selon Gordon Fishell, professeur de neurobiologie à l'université de Harvard, qui n'a pas participé à ces travaux, une mise en garde s'impose en ce qui concerne la perte de cellules PV chez les personnes atteintes du syndrome de l'X fragile. "La perte de cellules PV chez l'homme peut signifier la perte de cellules, ou simplement la perte de la [protéine] PV elle-même", dit-il, en faisant référence à la protéine parvalbumine produite par les neurones et que les chercheurs utilisent pour identifier les cellules. Les chercheurs le reconnaissent dans la discussion de leur article, dit-il, et ils ont vérifié que, chez les souris du modèle X fragile, les cellules elles-mêmes sont perdues. Mais d'autres recherches sont nécessaires pour étayer la même affirmation chez l'homme, ajoute-t-il.
On ne sait pas non plus si, sur la base de ces résultats, les futurs traitements du syndrome de l'X fragile devraient donner la priorité à la prévention de la perte des cellules PV, ajoute le Dr Fishell. Le fait de stimuler l'activité des cellules PV chez des souris âgées de 15 jours a permis de restaurer les circuits et d'améliorer les réponses sensorielles, même si la majorité des cellules PV étaient probablement mortes, dit-il, ce qui suggère que le ciblage de la fonction des circuits est plus important pour améliorer les caractéristiques sensorielles. "Mais soyons honnêtes, ils s'intéressent au sifflement. Ils ne s'intéressent pas à l'engagement cognitif".
Prévenir la mort des cellules PV dans le syndrome de l'X fragile peut finalement s'avérer être une stratégie importante pour le traitement à long terme de la condition, dit Kourdougli. Mais comme les cellules survivantes seront toujours dépourvues de FMRP, elles continueront à fonctionner de manière immature.
Par conséquent, dit-il, l'approche tardive de son groupe en matière d'intervention pourrait finir par être une bonne stratégie. "Sinon, d'autres études devront être menées pour identifier les mécanismes sous-jacents de cette immaturité et les cibler."
Citer cet article : https://doi.org/10.53053/UGBV4448



