thetransmitter.org Traduction de "CRISPR gives autism-linked genes a boost, rescues functioning" Par Giorgia Guglielmi - 23 mai 2024
Agrandissement : Illustration 1
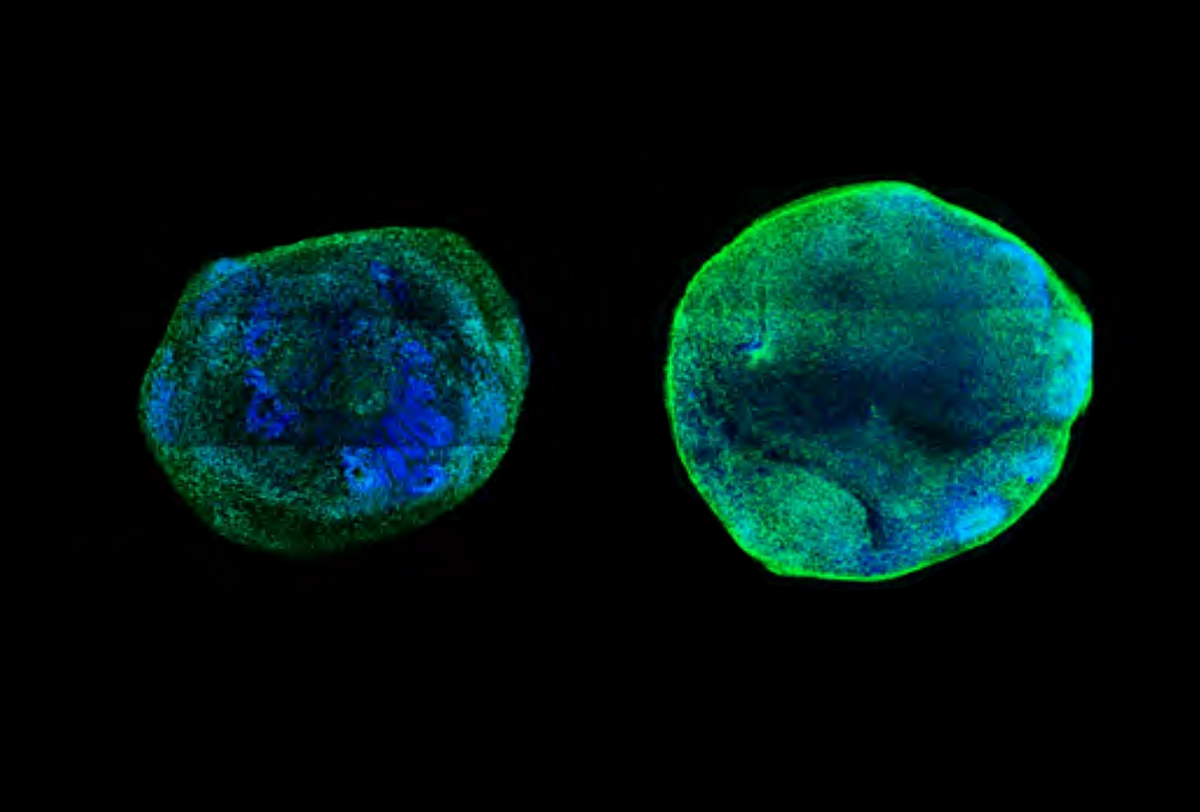
Selon une nouvelle publication, le traitement de neurones et d'organoïdes cérébraux avec une forme modifiée de CRISPR permet d'annuler les effets de variantes pathogènes dans deux gènes liés à l'autisme dont la fiabilité est élevée. L'approche stimule l'expression des gènes CHD8 et SCN2A en ciblant les structures qui les régulent.
SCN2A code pour un canal ionique qui aide à propager les signaux électriques dans le cerveau. Les variantes de ce gène sont associées aux crises d'épilepsie, à l'autisme et à la déficience intellectuelle. CHD8 est impliqué dans le remodelage de la chromatine, le complexe d'ADN et de protéines qui constitue les chromosomes. Les personnes présentant des copies défectueuses du CHD8 sont généralement autistes et ont une tête plus grosse que la moyenne.
Les travaux suggèrent que l'impact des variantes liées à l'autisme pourrait être inversé en modifiant l'expression des gènes, plutôt qu'en modifiant directement les gènes, bien que des recherches supplémentaires soient nécessaires avant que cette technique puisse trouver des applications dans la clinique, selon les experts.
"Il s'agit d'un autre moyen de réguler les gènes qui sont extrêmement importants dans [l'autisme], et c'est donc une découverte majeure", déclare Kevin Bender, professeur agrégé de neurologie à l'université de Californie à San Francisco, qui n'a pas participé à l'étude. "Mais c'est vraiment la première étape pour comprendre si cette approche est applicable à grande échelle."
Dans le passé, Bender et ses collègues ont utilisé la même version de CRISPR, qui active les gènes plutôt que de les modifier, pour stimuler l'expression de SCN2A chez des souris présentant une variante nocive dans une copie du gène. Le traitement a permis de corriger des problèmes dans les neurones des animaux.
En augmentant l'expression de SCN2A dans les neurones mutants et les organoïdes cérébraux, la nouvelle étude a confirmé bon nombre des résultats précédents. Mais les travaux ont également révélé, pour la première fois, que l'activation d'éléments régulateurs de gènes à l'aide de CRISPR pouvait contrecarrer les effets associés aux variantes nocives du CHD8.
Étant donné que ce gène contrôle l'expression de milliers d'autres gènes, "le fait de constater que la régulation à la hausse de CHD8 est réparatrice d'une certaine manière est vraiment passionnant", déclare Bender.
Pour augmenter l'expression du gène SCN2A, des travaux antérieurs ont ciblé les promoteurs des gènes, c'est-à-dire les fragments d'ADN qui initient la transcription de l'ADN en ARN. Bien que cette approche ne semble pas nuire, l'augmentation spectaculaire de l'expression de gènes tels que le CHD8 pourrait avoir des conséquences délétères, explique Daniel Geschwind, chercheur de l'étude et professeur distingué de neurologie, de psychiatrie et de génétique humaine à l'université de Californie, à Los Angeles.
Geschwind et son équipe ont donc utilisé CRISPR pour stimuler l'activité de régions non codantes du génome appelées "enhancers", qui peuvent réguler la transcription d'un gène, dans ce cas lié à SCN2A et CHD8.
La stimulation des enhancers de CHD8 dans les neurones et les organoïdes cérébraux dépourvus d'une copie fonctionnelle de ce gène a entraîné une réduction de la taille de l'organoïde et du nombre de gènes exprimés de manière différentielle. Cette découverte suggère que l'intervention peut sauver des cellules : sans elle, les organoïdes mutants CHD8 sont plus grands et présentent une surprolifération de cellules progénitrices neurales par rapport aux témoins qui ont deux copies fonctionnelles du gène.
De même, l'augmentation de l'expression de SCN2A a permis d'inverser les problèmes observés dans les neurones et les organoïdes cérébraux dépourvus de ce gène, notamment un développement altéré, une excitabilité réduite et des réponses lentes aux courants électriques.
L'équipe a publié ses résultats sur le serveur de préimpression bioRxiv en mars.
L'identification des activateurs de SCN2A et de CHD8 a été un exploit en soi, explique Bender. Les activateurs ne sont généralement pas situés à proximité des gènes qu'ils régulent. Pour les trouver, les scientifiques doivent se lancer dans une "chasse au trésor". "Leur capacité à le faire était vraiment remarquable, et ils l'ont fait pour deux gènes majeurs [liés à l'autisme].
Contrairement aux approches CRISPR traditionnelles, qui coupent l'ADN pour supprimer ou insérer des variantes et peuvent avoir des effets hors cible, l'activation CRISPR pourrait être moins susceptible de causer des dommages. Mais avant que cette approche ne soit utilisée en clinique, les chercheurs devront déterminer son profil de sécurité et rechercher d'éventuelles conséquences imprévues, explique Nadav Ahituv, professeur de bio-ingénierie et de sciences thérapeutiques à l'université de Californie à San Francisco, qui n'a pas participé à l'étude.
Ahituv, qui a travaillé avec Bender sur l'activation de SCN2A à l'aide de CRISPR, est cofondateur d'une société qui développe des thérapies CRISPR ciblant SCN2A et SCN1A, qui a également été lié à l'autisme.
Les chercheurs doivent également trouver un moyen adéquat d'administrer l'intervention au cerveau, explique M. Geschwind. "Les gens travaillent sur l'administration de gènes in-utero, donc je ne pense pas que ce soit si loin dans la prochaine décennie", dit-il. "Je suis assez optimiste quant à ce type d'approche."
La nouvelle étude, ajoute-t-il, évite également d'avoir à investir beaucoup de ressources et de temps pour déchiffrer les fonctions et les mécanismes des gènes individuels, et de développer des méthodes pour les contrer. Au lieu de cela, elle utilise les éléments régulateurs d'un gène pour activer son expression. "Pour moi, il s'agit d'un raccourci thérapeutique très intéressant."



