thetransmitter.org Traduction de "Microglial overreaction to atypical neurons may drive autism" - Holluy Barker - 7 décembre 2023
La réaction excessive de la microglie aux neurones atypiques pourrait être à l'origine de l'autisme
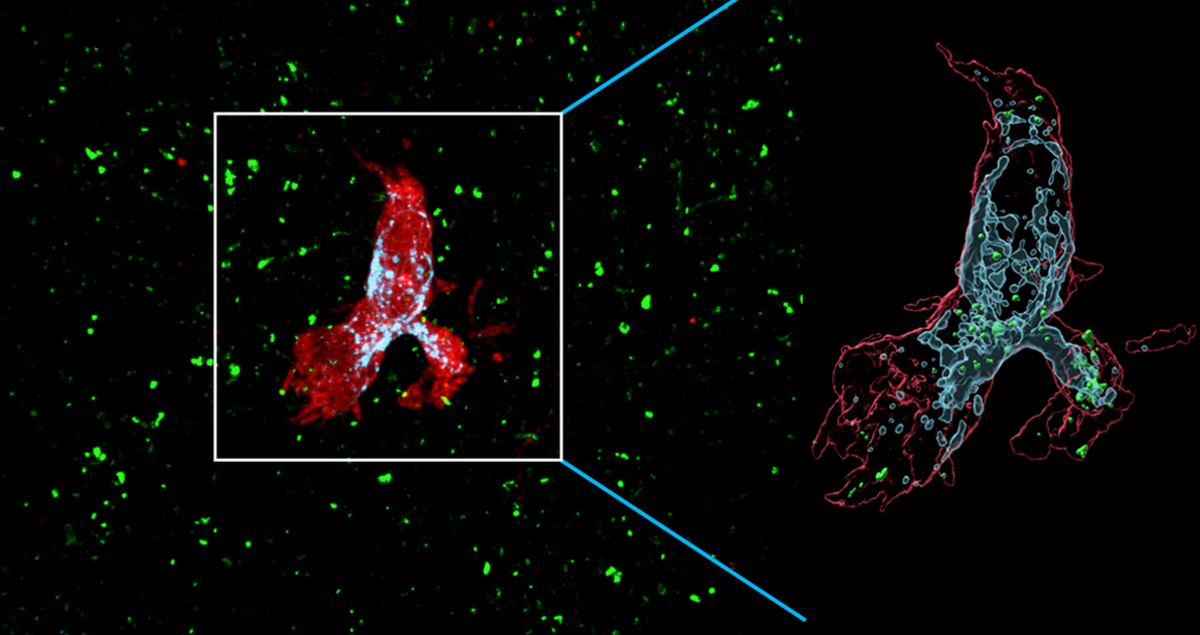
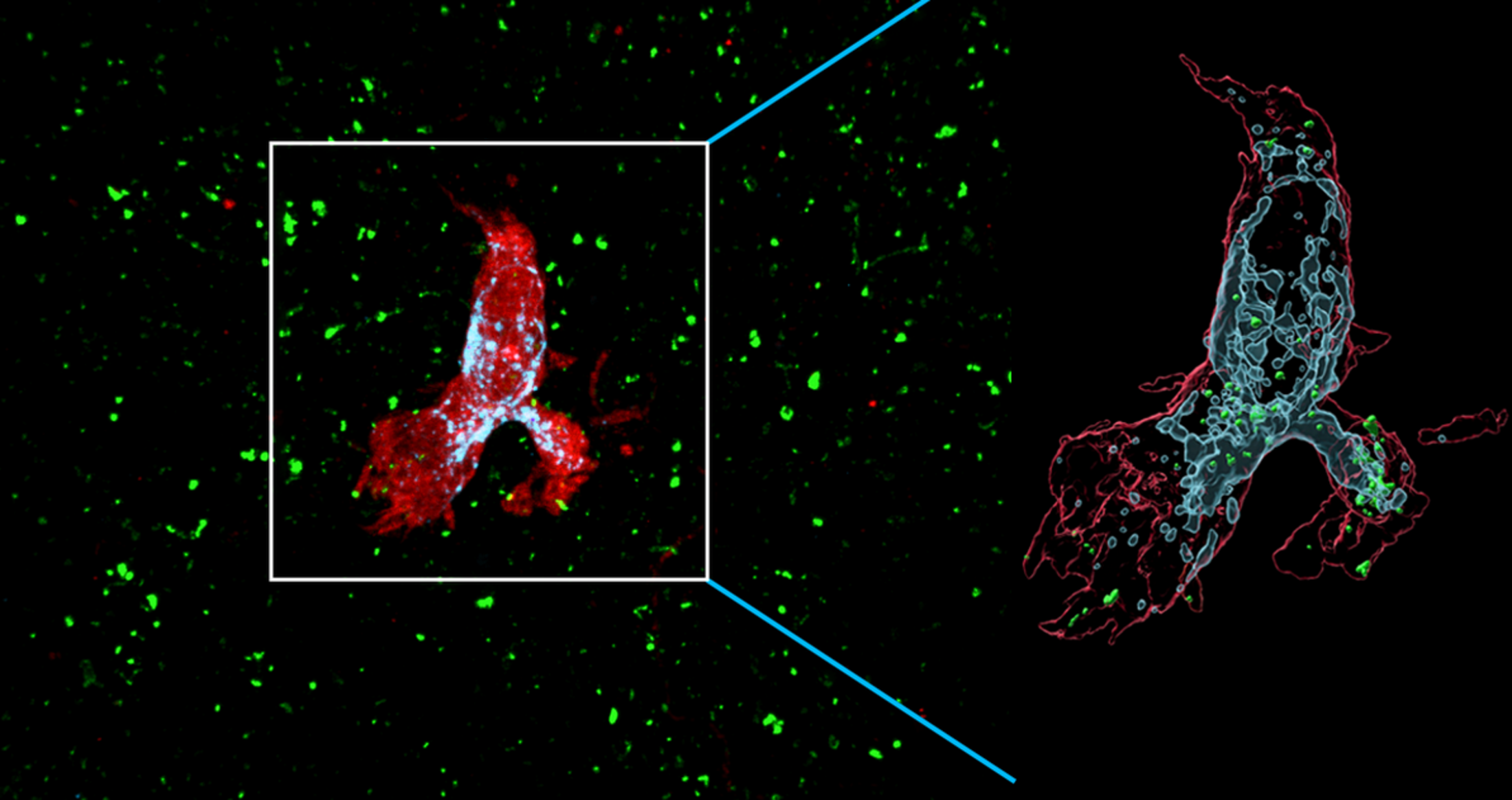
Agrandissement : Illustration 1
Lorsqu'elle a été découverte, la microglie - du mot grec signifiant "colle" - semblait simplement soutenir les neurones. Mais cette première évaluation ne pouvait pas être plus éloignée de la vérité. Entre autres rôles, elles avalent les agents pathogènes envahissants, sécrètent des facteurs de croissance et éliminent les connexions neuronales inutiles.
Avec une seule tâche à accomplir, les neurones sont paresseux en comparaison, explique Auguste Vadisiute, jeune chercheuse au St John's College de l'université d'Oxford, au Royaume-Uni. La microglie est leur système de soutien, dit-elle, et elle est un régulateur essentiel de la fonction neuronale.
Plusieurs nouveaux éléments de preuve impliquent la microglie comme un facteur clé de l'altération de la connectivité cérébrale dans l'autisme. Selon une nouvelle publication, les souris dépourvues du gène SCN2A lié à l'autisme présentent une microglie hyperactive et moins de connexions neuronales que les souris de type sauvage. L'étude révèle que l'épuisement de la microglie améliore la connectivité.
La perte de SCN2A dans les neurones - les seules cellules qui expriment le gène - peut inciter la microglie à agir, explique Jiaxiang Wu, chercheur postdoctoral à l'université Purdue de West Lafayette, dans l'Indiana. Ces travaux "ouvrent de nouvelles perspectives" pour le traitement de l'autisme en contrôlant la réponse immunitaire, ajoute-t-il.
Les résultats soulignent également l'importance des interactions entre les neurones et la microglie, déclare Florent Ginhoux, chercheur principal au Singapore Immunology Network, qui n'a pas participé à l'étude. "Ils révèlent l'importance des échanges entre les neurones et la microglie, cette dernière étant le moteur du trouble", explique-t-il.
Une activité microgliale anormale peut avoir des effets néfastes sur le cerveau, comme le suggèrent des études réalisées au cours de la dernière décennie. L'hyperactivation des cellules au cours du développement - peut-être causée par une infection pendant la grossesse - pourrait altérer la connectivité et prédisposer les personnes à l'autisme.
À l'appui de cette théorie, certaines personnes autistes présentent un nombre anormalement élevé de ce qui semble être une microglie active, selon des études post mortem et d'imagerie en direct. Ces cellules, qui se comportent différemment dans le cerveau des souris mâles et femelles, pourraient contribuer au déséquilibre entre les sexes dans l'autisme.
Pourtant, les scientifiques se demandent si la microglie joue un rôle de premier plan ou si elle réagit simplement à des conditions cérébrales modifiées. Jusqu'à présent, les données indiquent que la microglie joue un rôle prépondérant. Par exemple, une autre étude a montré que la microglie chargée d'un excès de protéines déclenche des comportements similaires à ceux de l'autisme chez les souris mâles.
Mais certaines de ces recherches sont nuancées ou controversées. Les greffes de moelle osseuse - une source de microglie - inversent les traits d'un modèle murin du syndrome de Rett, a suggéré une étude de 2012. Cependant, une étude ultérieure n'a pas réussi à reproduire ce résultat.
Dans la nouvelle étude, un court fragment d'ADN - connu sous le nom de "piège à gènes" - a réduit l'expression de SCN2A à 25 % des niveaux habituels. Les souris conçues avec le gène piégé présentaient des problèmes d'apprentissage et de mémoire, ainsi qu'une transmission synaptique réduite.
La coloration des neurones dans le centre de la mémoire du cerveau - l'hippocampe - a révélé une diminution des épines dendritiques, ces minuscules branches neuronales qui reçoivent des signaux d'autres neurones. Ces épines étaient plus susceptibles d'être immatures et formaient moins de synapses que d'habitude. Ces changements sont apparus dès le 30ème jour postnatal, ce qui coïncide avec des niveaux stables de microglie dans le cerveau de la souris.
La microglie des souris déficientes en SCN2A a également produit plus de lysosomes - des sacs cellulaires remplis d'enzymes digestives - ce qui suggère un plus grand appétit pour la destruction des synapses. Les chercheurs ont constaté que le traitement par un médicament qui détruit la microglie rétablissait partiellement la transmission synaptique et la densité des épines.
Les microglies réagissent de la même manière que les neurones humains, a constaté l'équipe en utilisant des organoïdes cérébraux cultivés à partir de cellules souches modifiées pour exprimer une mutation du gène SCN2A liée à l'autisme. Les microglies injectées dans ces boules de tissu cérébral sont devenues plus actives - et ont démantelé plus de synapses - que celles ajoutées à des organoïdes constitués de neurones non mutés.
Ces travaux suggèrent que l'activité microgliale, plutôt que la perte de SCN2A - un canal ionique sodique qui aide les neurones à envoyer des signaux électriques - altère la connectivité dans le cerveau, explique Yang Yang, chercheur principal et professeur agrégé de chimie médicinale et de pharmacologie moléculaire à l'université de Purdue. Les chercheurs ont publié le préprint sur Research Square en septembre.
"Il est tout à fait fascinant de voir qu'ils peuvent récapituler leurs principales observations dans l'organoïde humain", déclare M. Ginhoux. Mais ils pourraient aller plus loin, ajoute-t-il, en utilisant le système modèle pour comprendre les interactions qui font que la microglie réagit mal aux neurones atypiques.
Les "méthodes expérimentales sont à la pointe du progrès", reconnaît Christopher Coe, professeur émérite de biopsychologie à l'université du Wisconsin-Madison, qui n'a pas participé à l'étude. Mais les résultats ne représentent probablement qu'une fraction de la population autiste, ajoute-t-il. "Il n'existe pas vraiment un seul type de TSA. Il est probable qu'il n'y aura pas qu'une seule explication".
Yang prévoit d'étudier le câblage neuronal chez des souris chimériques, dans lesquelles des neurones humains mutés SCN2A se développent dans le cerveau de la souris. Lui et son équipe ont ensuite l'intention de corriger la mutation pour voir si les microglies réagissent différemment aux neurones.
Les résultats de cette étude et d'autres études similaires suggèrent également que la microglie pourrait être une cible thérapeutique, une stratégie déjà explorée pour la maladie d'Alzheimer. Toutefois, cette approche exigera des scientifiques qu'ils préservent le rôle bénéfique des cellules tout en éliminant leurs effets néfastes, ce qui ne sera pas facile, selon Yang. "Il reste encore beaucoup de chemin à parcourir, mais c'est un domaine passionnant."
Yang ajoute qu'il espère que davantage de chercheurs s'intéresseront à la microglie. "Lorsque nous étudions l'autisme, nous commençons par une approche neurocentrique. Il est grand temps de rendre à la "colle" du cerveau la place qui lui revient.



