Ces dernières semaines, plusieurs annonces ont été faites sur l’H2 : la SNCF a évoqué des trains à hydrogène [1], Airbus des avions, le gouvernement français imite le gouvernement allemand et souhaite consacrer plusieurs milliards d’euros du plan de relance à cette filière [2] [3]... On connait finalement assez mal ce gaz, tantôt manne miraculeuse pour les uns, tantôt chimère inutile pour les autres. S’il est probable que la vérité se situe entre ces deux extrêmes, tentons de dresser un panorama factuel de cette nouvelle technologie.
Le dihydrogène est un gaz, et comme tous les gaz, il est formé de molécules. Ces molécules, de petites billes de matière indépendantes les unes des autres qui se meuvent aléatoirement dans l’espace qui les emprisonne, sont composées de deux atomes d’hydrogène. Par abus de langage (et également parce que notre époque préfère raccourcir et simplifier), la dénomination de ce gaz est la plupart du temps réduite à celle des atomes qui le compose : l’hydrogène. C’est également ainsi que nous le nommerons désormais, sauf quand cela peut porter à confusion, et la distinction sera alors précisée.
Simple, basique (et léger)
Laissons le gaz et ses molécules de côté encore quelques instants : l’atome d’hydrogène mérite qu’on s’attarde sur ses caractéristiques propres. Elles sont à l’origine des avantages et des inconvénients qui pullulent dans les argumentaires des pro et des anti hydrogène.
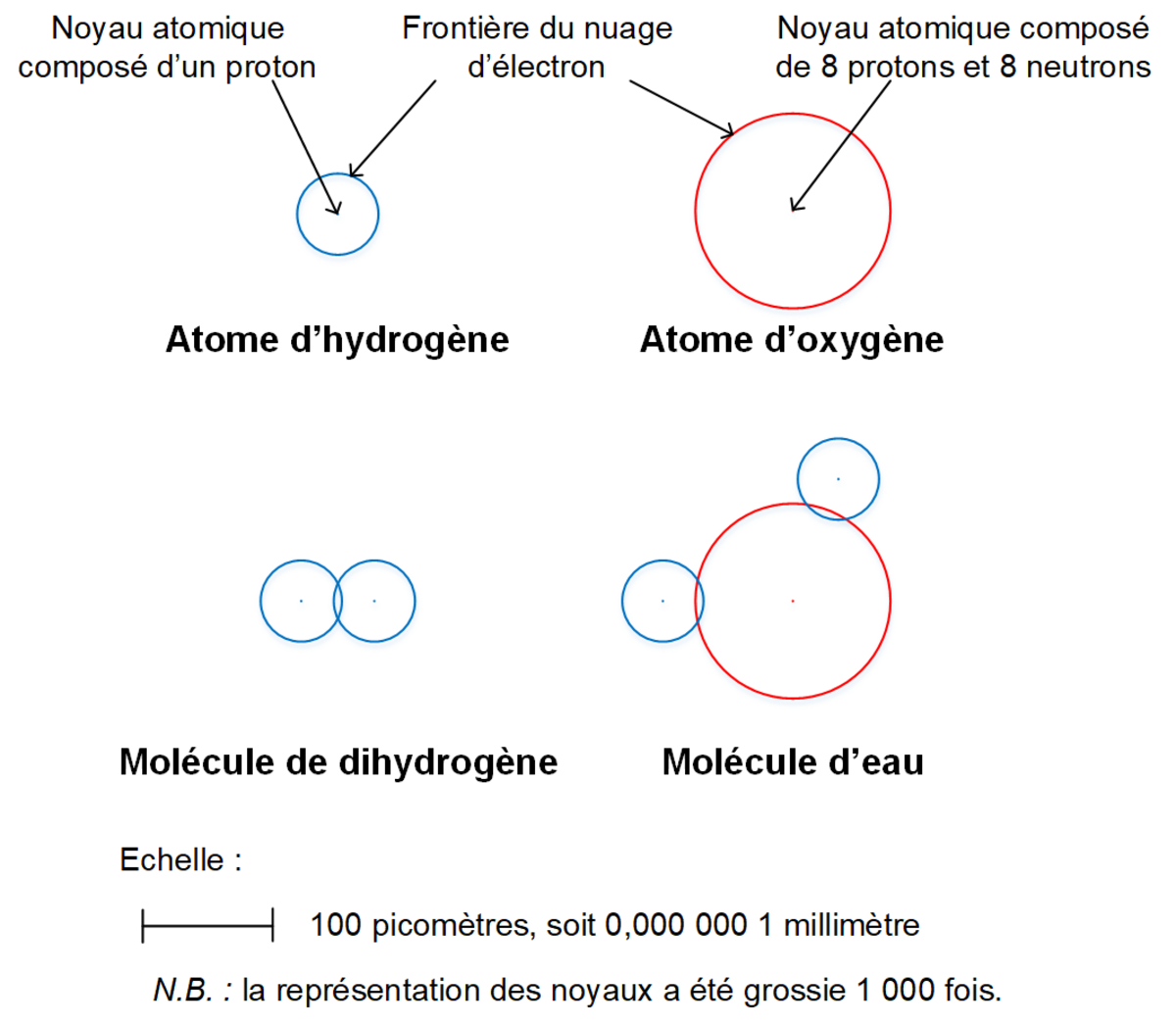
Agrandissement : Illustration 1

Les atomes sont les constituants élémentaires de la matière, qu’elle soit solide, liquide ou gazeuse. Ces grains de matière sont constitués d’un noyau formé de grains encore plus petits : des neutrons et des protons. A ce jour, 118 atomes ou éléments chimiques différents ont pu être observés, et en 1869, le russe Dmitri Mendeleïev eut l’idée de les répertorier dans un tableau qui porte encore son nom aujourd’hui. Dans cette classification périodique, l’hydrogène mène la danse. Il tient la première place, en haut à gauche, car son atome n’est constitué que d’un seul petit proton (et aucun neutron), alors que tous ses poursuivants possèdent tous plusieurs protons et plusieurs neutrons. Cette composition élémentaire en fait l’élément le plus simple et le plus léger de l’univers.
Le plus simple car l’hydrogène est l’élément chimique originel de toute la matière que nous connaissons aujourd’hui. Apparu très tôt dans la chronologie de la naissance de l’univers, cet atome est encore le principal constituant de la plupart des étoiles, de la plupart des planètes géantes et de la matière intergalactique : 9 atomes sur 10 de l’univers qui nous entoure est un atome d’hydrogène [4]. Sur Terre, l’atome d’hydrogène est abondant, mais il est systématiquement combiné avec des atomes différents, dans l’eau par exemple, dont la molécule est composée de deux atomes d’hydrogène et d’un atome d’oxygène.
Si sur Terre, il n’est que très rarement présent sous forme de dihydrogène gazeux, c’est en raison de sa seconde caractéristique : ce gaz est si léger que même l’attraction terrestre ne parvient pas à le retenir ! Laissée libre dans l’atmosphère, une molécule de dihydrogène s’élèvera naturellement vers les cieux et, comme l’ascenseur extraordinaire de Willy Wonka quittera petit à petit notre chère planète bleue. Un litre de ce gaz pèse 90 mg à pression atmosphérique, soit 11 fois moins qu’un litre d’air qui nous entoure ! [4]
Jadis, cette caractéristique a bien été exploitée : elle a fait le bonheur de l’industrie aéronautique pendant l’entre-deux-guerres, à une époque où le dihydrogène était le principal constituant des immenses dirigeables qui furent alors construits. Sa légèreté ainsi que la relative simplicité de sa fabrication lui permirent dans un premier temps d’être préféré à l’hélium (pourtant second de la classe dans le tableau de Mendeleiev, donc un peu plus lourd et un peu moins performant pour élever des charges lourdes dans les airs, mais complétement inoffensif).

Hélas c’est une autre caractéristique du dihydrogène (du gaz, et non de l’atome) qui lui valut une rapide relégation au rang de persona non grata de l’industrie aéronautique : son caractère inflammable. Différents accidents eurent lieu avant que la tristement célèbre catastrophe du dirigeable Hindenburg ne mette définitivement fin à son utilisation comme gaz porteur de ces géants des airs. A son arrivée aux Etats-Unis le 6 mai 1937, le LZ 129 Hindenburg, plus grand dirigeable commercial affecté sur une ligne régulière Europe Etats-Unis, prend feu, tuant 35 personnes [5]. L’évènement est filmé par plusieurs compagnies de cinéma de l’époque et des images impressionnantes font rapidement le tour du monde, marquant profondément et durablement l’opinion publique sur son caractère dangereux.
Vers un nouveau vecteur énergétique
Car c’est bien et bien cet aspect du dihydrogène qui intéresse ses ardents défenseurs d’aujourd’hui : il concentre une quantité d’énergie importante, et la combustion de ce gaz dans le dioxygène est particulièrement exothermique, c’est-à-dire qu’elle produit (beaucoup) plus d’énergie qu’elle n’en consomme. Combustion, donc fumée et pollution, direz-vous ? Vous vous trompez : en plus de cette précieuse énergie, cette combustion a l’immense avantage de ne produire que de la vapeur d’eau, non polluante (si tant est qu’il faille le rappeler). C’est d’ailleurs ce qui lui vaut son nom : hydro-gène, qui engendre l’eau. Et uniquement de l’eau.
Certes, en l’absence de source naturelle de dihydrogène sur Terre, il ne peut être une nouvelle source d’énergie primaire, comme le sont pétrole, charbon, gaz, et autres ressources fossiles fortement nocives pour l’atmosphère terrestre. Néanmoins, ses attraits en font pour l’instant un vecteur énergétique idéal. Nous y reviendrons.
Attardons nous quelques instants sur l’énergie que ce gaz emmagasine. Toute combustion émet de l’énergie thermique (de la chaleur), que l’on peut mesurer. Si on la quantifie cette énergie pour différents combustibles, et que l’on ramène cette énergie à son poids, ou à son volume, on obtient une densité d’énergie par unité de poids et de volume. C’est ce que le graphique suivant représente pour différentes sources d’énergie usuelles (on ne s’est pas limité aux seuls combustibles).

Agrandissement : Illustration 3

Au cours de l’histoire, depuis la domestication du feu il y a 400 000 ans, l’être humain a d’abord tiré parti de l’énergie du bois. Puis au cours du XIXème siècle, il a découvert le charbon qu’il a jugé plus efficace (à raison), avant de se ruer vers le pétrole et tous ses dérivés (gazole, essence, fioul, kérosène, gaz naturel, etc.) qui ont l’immense avantage d’être liquide, et enfin, vers l’énergie nucléaire. A l’aune de ce constat, la lecture du graphique montre que l’Homme s’est progressivement tourné vers des sources d’énergie de plus en plus dense massiquement. Dans ce palmarès, l’hydrogène joue encore les premiers de classe puisque c’est le combustible qui dispose de l’énergie massique la plus élevée (l’uranium n’est pas à proprement parlé un combustible : il ne brule pas) : un petit kilogramme d’hydrogène permet de produire 33 kWh d’énergie thermique, 3 fois plus qu’un kilogramme d’essence, soit l’énergie nécessaire qu’il faut pour hisser 60 fois une automobile en haut de la Tour Eiffel à bout de bras ! [6]
Un combustible dense en énergie, mais volumineux
Malheureusement, ce petit kilogramme d’hydrogène est en fait très grand… en volume ! En effet, à pression atmosphérique, il faut 11 m3 pour stocker 1 kg d’hydrogène, soit le volume d’une petite chambre. Ici, comme pour l’ensemble des combustibles gazeux (comme le gaz naturel, ou le monoxyde de carbone), sa légèreté joue en sa défaveur : à pression atmosphérique, il faut un volume conséquent pour stocker de l’énergie sous forme d’hydrogène. Si cela n’est pas gênant pour des applications statiques (comme la production d’électricité), c’est en revanche plus problématique pour les applications mobiles (comme le transport). Il faut alors embarquer son carburant, et mieux vaut qu’il prenne le moins de place possible…
Ce problème peut être en partie résolu par la compression. Pour des applications embarquées sur des véhicules, par exemple, il est usuel de comprimer l’hydrogène à 350 ou à 700 bars. A de telles pressions, sa densité d’énergie volumique atteint le même ordre de grandeur que les produits pétroliers, sans les égaler néanmoins. Il est même possible de le condenser pour en faire un liquide : le dihydrogène se liquéfie à pression atmosphérique à la température de -252°C. Il faut alors disposer d’un congélateur performant.
Bref, pour augmenter la densité d’énergie volumique de l’hydrogène, deux solutions : soit il faut comprimer, soit il faut refroidir (beaucoup). Un sacré inconvénient, qui n’est cependant pas impossible de surmonter, nous le verrons par la suite. On remarquera au passage que les batteries électriques offrent, en termes de densités énergétiques, des performances ridicules.
Enfin, si elle est peu utile dans le cadre de la production d’énergie, il faut néanmoins signaler une dernière caractéristique importante du dihydrogène : c’est un excellent fluide caloporteur (littéralement : porteur de chaleur). Cela signifie qu’il peut intervenir avec efficacité dans des échangeurs de chaleur, des systèmes de refroidissement par exemple.
Nous voici donc armés des principales connaissances de base pour affronter les applications pratiques du dihydrogène. Gaz très léger, rare, voire inexistant sous forme naturelle sur Terre, l’atome qui le compose est à l’inverse abondant dans notre entourage proche et lointain. Incolore, inodore, le dihydrogène est un excellent combustible qui contient une quantité d’énergie importante par unité de masse, mais faible par unité de volume. Sa combustion offre l’avantage indéniable de ne produire que de la vapeur d’eau, raison pour laquelle il est fréquemment présenté comme l’acteur principal d’une future révolution énergétique. Voyons tout d’abord comment il peut en prendre le chemin.
Article suivant : hydrogène : la promesse d’un nouveau vecteur énergétique ?
Pour aller plus loin :
[1] Site internet de SNCF, SNCF accélère le déploiement du train à hydrogène, publié le 18 février 2020.
[2] Le Monde, L’Allemagne veut devenir le pays de l’hydrogène, publié par Cécile Boutelet le 13 juin 2020.
[3] Le Monde, La France prête à relever le pari risqué de l’hydrogène, publié par Nabil Wakim le 3 septembre 2020.
[4] Données issues du site internet L’élémentarium créé par la Société Chimique de France et financé par les Ministères en charge de l’Éducation Nationale et de l’Enseignement Supérieur, et notamment de son article consacré au dihydrogène : https://www.lelementarium.fr/product/dihydrogene/.
[5] France Culture, La catastrophe du Hindenburg en photo, la fin du géant des airs par Tatiana Chadenat le 16 août 2019.
[6] Or noir, la grande histoire du pétrole, Matthieu Auzanneau, éditions La Découverte.



