nature.comTraduction de "How gut microbes could drive brain disorders" - 3 février 2021 - Cassandra Willyard - Nature 590, 22-25 (2021)
En 2006, peu après avoir lancé son propre laboratoire, la neuroscientifique Jane Foster a découvert quelque chose qui, selon elle, allait faire bouger les choses dans son domaine. Avec son équipe, elle travaillait avec deux groupes de souris : l'un avec une sélection saine de micro-organismes dans leurs intestins, et l'autre sans microbiome. Ils ont remarqué que les souris sans bactéries intestinales semblaient moins anxieuses que leurs équivalents sains. Lorsqu'elles ont été placées dans un labyrinthe avec des chemins ouverts et d'autres clos, elles ont préféré les chemins découverts. Les bactéries intestinales semblaient influencer leur cerveau et leur comportement.
Foster, de l'université McMaster à Hamilton, au Canada, a rédigé l'étude et l'a soumise pour publication. Elle a été rejetée. Elle l'a réécrite et l'a envoyée à nouveau. Rejetée. "Les gens ne l'ont pas crue. Ils pensaient que c'était un artefact", dit-elle. Finalement, après trois ans et sept soumissions, elle a reçu une lettre d'acceptation 1.
John Cryan, un neuroscientifique de l'University College Cork en Irlande, a rejoint le sujet à peu près au même moment que Foster, et sait exactement ce qu'elle a ressenti. Lorsqu'il a commencé à parler des liens entre les bactéries vivant dans l'intestin et le cerveau, "je me suis senti très évangélique", dit-il. Il se souvient d'une conférence sur la maladie d'Alzheimer à laquelle il a fait une présentation en 2014. "Je n'ai jamais donné une conférence dans une salle où il y avait moins d'intérêt".
Aujourd'hui, cependant, l'axe intestin-cerveau est à l'honneur dans les grandes réunions de neurosciences, et Cryan affirme qu'il n'est plus "ce fou d'Irlande". Des milliers de publications au cours de la dernière décennie ont révélé que les billions de bactéries présentes dans l'intestin pourraient avoir des effets profonds sur le cerveau, et pourraient être liées à toute une série de troubles. Des bailleurs de fonds tels que les Instituts nationaux de la santé des États-Unis investissent des millions de dollars dans l'exploration de ce lien.
Mais cette explosion d'intérêt s'est accompagnée d'un battage médiatique. Certains chercheurs qui s'intéressent au cerveau prétendent ou laissent entendre qu'il existe une relation de cause à effet alors que de nombreuses études ne montrent que des corrélations, et de façon peu convaincante, explique Maureen O'Malley, philosophe de l'université de Sydney en Australie qui étudie le domaine de la recherche sur le microbiome. "Avez-vous trouvé une cause réelle, ou avez-vous trouvé juste un autre effet ?"
Ces dernières années, cependant, le domaine a fait des progrès significatifs, dit O'Malley. Plutôt que de parler du microbiome dans son ensemble, certaines équipes de recherche ont commencé à creuser pour identifier des microbes spécifiques, en traçant les voies complexes et parfois surprenantes qui les relient au cerveau. "C'est ce qui permet d'établir des attributions causales", dit-elle. Des études sur les souris - et des travaux préliminaires sur les humains - suggèrent que les microbes peuvent déclencher ou modifier l'évolution de conditions telles que la maladie de Parkinson, les troubles du spectre autistique et bien d'autres (...). Les thérapies visant à modifier le microbiome pourraient contribuer à prévenir ou à traiter ces troubles, une idée que certains chercheurs et entreprises testent déjà dans le cadre d'essais cliniques chez l'homme.
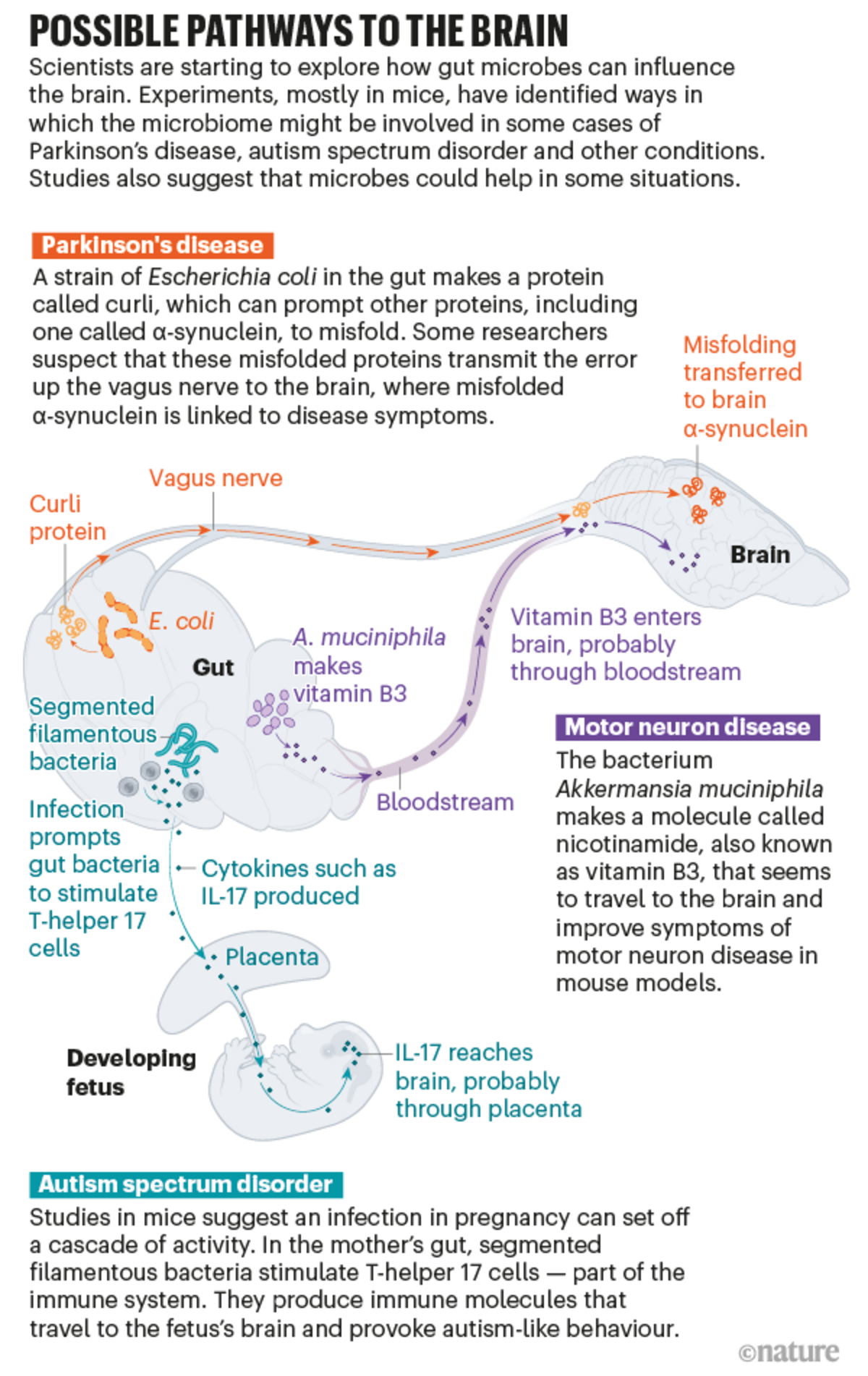
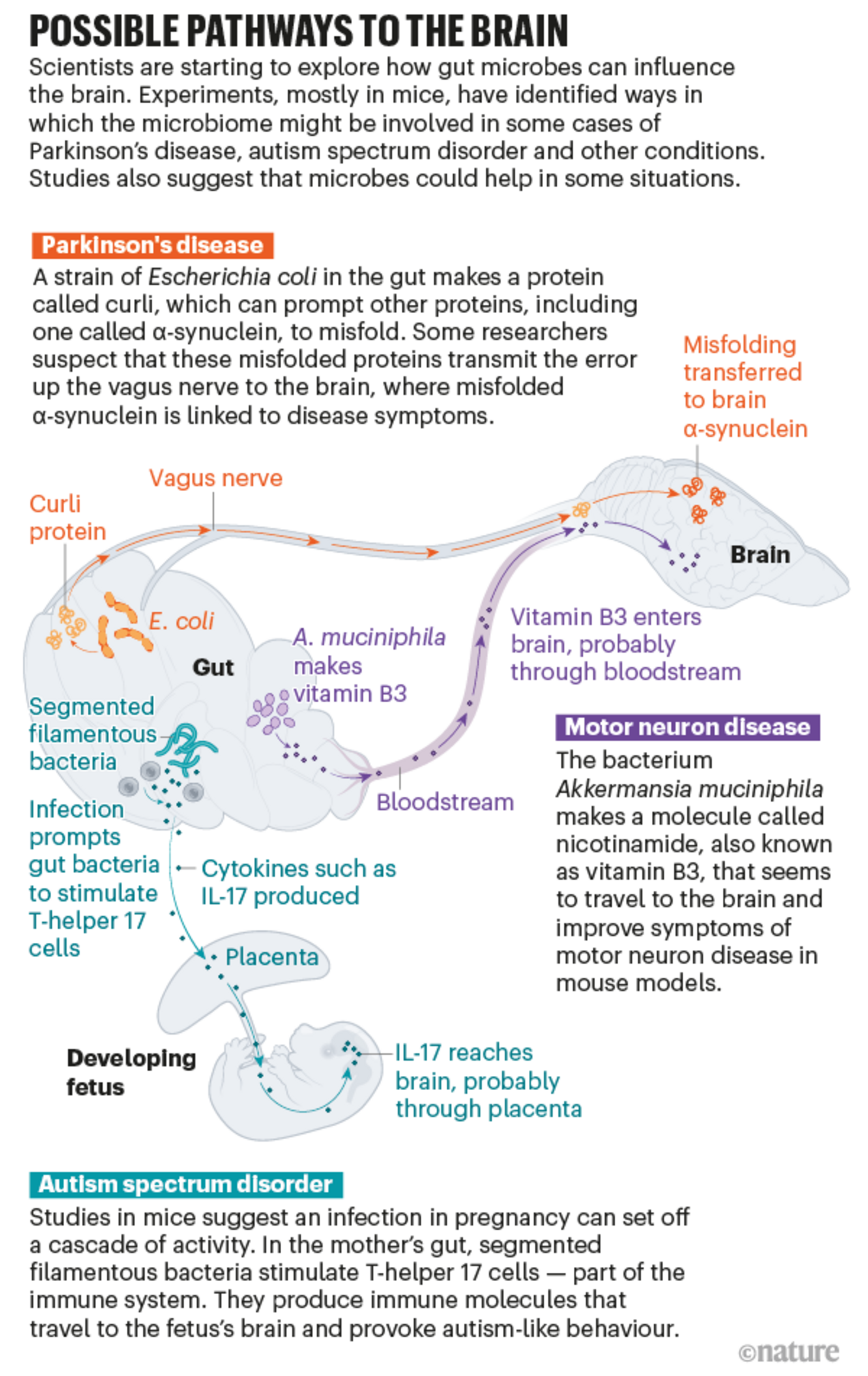
Agrandissement : Illustration 1
Nous n'en sommes qu'au début, mais la perspective de nouvelles thérapies pour certaines de ces maladies cérébrales incurables est passionnante, déclare Sarkis Mazmanian, microbiologiste au California Institute of Technology de Pasadena - d'autant plus qu'il est beaucoup plus facile de manipuler l'intestin que le cerveau. La mise au point de thérapies dans le cerveau est un défi de longue date, dit-il, "mais vous pouvez certainement changer le microbiome".
La transmission enchevêtrée
En 1817, le chirurgien anglais James Parkinson a décrit certains des premiers cas de "paralysie secouante" qui seront connus sous le nom de maladie de Parkinson. Un individu avait développé un engourdissement et des sensations de picotements dans les deux bras. Parkinson a remarqué que l'abdomen de l'homme semblait contenir une "accumulation considérable". Il lui a administré un laxatif, et dix jours plus tard, ses intestins étaient vides et ses symptômes avaient disparu.
Parkinson était peut-être sur une piste. Certaines personnes qui développent la maladie souffrent de constipation bien avant de développer des problèmes de mobilité. Et de nombreux chercheurs ont adopté l'idée que la maladie commence dans l'intestin, du moins dans certains cas.
Pour comprendre cette idée, il est utile d'en savoir un peu plus sur la maladie. Les symptômes caractéristiques de la maladie de Parkinson - tremblements, raideur et lenteur des mouvements - apparaissent lorsque les neurones responsables de la coordination des mouvements commencent à mourir. On ne sait pas exactement pourquoi ces neurones meurent, mais une protéine connue sous le nom de α-synucléine semble jouer un rôle clé. Chez les personnes atteintes de la maladie de Parkinson, la protéine se dérègle. La première protéine mal repliée en entraîne d'autres, jusqu'à ce que des amas nocifs, appelés corps de Lewy, commencent à se former dans le cerveau.
Qu'est-ce qui déclenche cette cascade ? En 2015, Robert Friedland, neurologue à l'université de Louisville dans le Kentucky, a proposé une nouvelle théorie. Il avait lu que les bactéries intestinales peuvent produire des protéines qui ont une structure similaire à celle des protéines de la synucléine déformée α. Il a donc émis l'hypothèse que les protéines bactériennes pourraient fournir un modèle pour le mauvais pliage 2. Et lorsque lui et ses collègues ont donné à des rats une souche particulière d'Escherichia coli qui produit dans l'intestin l'une de ces protéines agglomérantes, appelée curli, ils ont vu davantage de α-synucléines s'accumuler dans le cerveau des animaux 3. Les travaux publiés l'année dernière par Mazmanian et son équipe soutiennent la théorie de Friedland 4.
On ne sait pas encore très bien comment ce signal dans l'intestin atteint le cerveau, mais le nerf vague est probablement un des conduits. Le nerf vague relie le tronc cérébral à de nombreux organes, dont le côlon, ce qui en fait le plus long des douze nerfs crâniens qui transportent les signaux entre le cerveau et le reste du corps. "C'est vraiment une autoroute", dit Cryan. Et les recherches menées sur les humains et les animaux suggèrent qu'il joue un rôle crucial dans le transport d'au moins certains messages entre l'intestin et le cerveau.
Dans les années 1970, une thérapie courante pour les ulcères d'estomac consistait à retirer tout ou partie du nerf pour freiner la production d'acide dans l'estomac. Mais au cours des dernières décennies, les chercheurs ont constaté un étrange effet secondaire : les personnes ayant subi cette procédure semblaient moins susceptibles de souffrir de la maladie de Parkinson 5.
Lors d'une étude sur des souris, l'injection dans l'intestin d'une synucléine α mal pliée a permis de la produire dans le cerveau. Mais si les chercheurs ont d'abord retiré le nerf vague, aucune synucléine α n'est apparue dans le cerveau 6. La synucléine α injectée semble elle-même rester dans l'intestin, mais Valina Dawson, une neuroscientifique de l'université Johns Hopkins de Baltimore, Maryland, qui a participé à l'étude, pense qu'il pourrait y avoir un effet domino : les protéines mal pliées transmettent l'erreur par le nerf vague jusqu'à ce que les protéines du cerveau finissent par se replier. Mazmanian et ses collègues mènent actuellement des expériences pour voir si la protéine curli présente dans l'intestin peut encore provoquer les symptômes de la maladie de Parkinson chez les souris dont le nerf vague a été sectionné.
Parce que les protéines mal repliées sont la marque de plusieurs autres conditions qui affectent le cerveau, y compris la maladie d'Alzheimer et la maladie des motoneurones (sclérose latérale amyotrophique, ou SLA), Friedland dit que les protéines bactériennes pourraient être impliquées dans ces maladies, aussi. Dawson trouve l'idée plausible, mais affirme que les amyloïdes bactériennes ne sont pas le seul facteur à prendre en compte. La maladie de Parkinson, par exemple, est une maladie complexe qui se présente différemment selon les personnes. Pourtant, dit-elle, "cela pourrait être un moyen de faire démarrer les choses".
Accélérer le déclin
Les partisans du lien entre l'intestin et le cerveau affirment que le microbiome pourrait faire plus que déclencher certains cas de maladies neurodégénératives : il pourrait également avoir des effets sur la gravité de ces dernières. Eran Elinav, immunologiste à l'Institut Weizmann des sciences à Rehovot, en Israël, et au Centre allemand de recherche sur le cancer à Heidelberg, a été frappé par les différences dans la façon dont la SLA peut se développer : certaines personnes atteintes progressent lentement, et d'autres se détériorent rapidement. Elinav s'est demandé si le microbiome permettait d'expliquer ces différences, c'est pourquoi lui et son équipe ont commencé à travailler avec l'un des modèles murins de SLA les plus courants. Lorsqu'ils ont éliminé le microbiome avec des antibiotiques, ou utilisé des souris dépourvues de microbiome dès la naissance, ils ont constaté une progression de la maladie beaucoup plus rapide que chez les souris ayant un microbiome normal 7.
L'équipe a comparé les bactéries intestinales des souris atteintes de SLA avec celles de leurs compagnons de portée en bonne santé, et a trouvé plusieurs espèces microbiennes qui semblaient être liées à la maladie. Ils ont minutieusement transplanté ces espèces, une par une, dans un autre groupe de souris dépourvues de bactéries intestinales, identifiant deux espèces qui aggravaient les symptômes de la SLA et une qui semblait les soulager. "Nous nous sommes ensuite demandé comment cette souche qui ne vit que dans l'intestin pouvait avoir un impact aussi incroyable sur une maladie qui se concentre sur le cerveau. dit Elinav.
Micrographie de bactéries filamenteuses segmentées faisant germer des filaments
Agrandissement : Illustration 2
Les coupables pourraient être des métabolites bactériens - de petites molécules produites par des bactéries qui peuvent entrer dans la circulation sanguine et voyager dans le corps. Au moins la moitié de toutes les petites molécules du sang sont "soit fabriquées par des microbes, soit modulées par des microbes", explique Elinav. Avec son équipe, il a analysé les métabolites produits par le microbe bénéfique et en a administré un, une molécule appelée nicotinamide - également connue sous le nom de vitamine B3 - à des souris sujettes à la SLA. Ils ont découvert que la molécule pénétrait dans le cerveau et améliorait leurs symptômes 7 : "Nous avons pu prouver qu'il y avait une bactérie, nous avons pu prouver qu'il y avait un produit de la bactérie, et nous avons pu prouver qu'elle nageait vers le bon organe cible et faisait quelque chose de favorable à l'évolution de la maladie", dit-il.
Lorsqu'ils ont comparé les microbiomes des personnes atteintes de SLA et ceux des membres de leur famille non affectés, ils ont constaté une diminution de la nicotinamide chez les personnes atteintes de SLA 7. Le métabolite est facilement disponible sous forme de supplément, et M. Elinav dit que ses collègues et lui prévoient d'en faire un essai clinique.
Au moins un groupe a déjà testé la vitamine B3 comme traitement de la SLA dans un petit essai, bien qu'il s'agisse d'une version combinée avec un autre composé. Ils l'ont administrée à des participants atteints de SLA pendant quatre mois. Les personnes du groupe de traitement ont montré une certaine amélioration, mais la santé de presque toutes les personnes du groupe placebo a décliné8.
"Ce n'est que le début", dit Elinav. Il existe beaucoup plus de bactéries et de métabolites, et chaque cellule du corps est ouverte à leurs effets. Une fois que vous vous en rendez compte, dit-il, "vous commencez à comprendre que l'effet du microbiome pourrait s'étendre bien au-delà du lieu où vivent réellement les microbes".
Effets générationnels
L'effet pourrait même se transmettre d'une génération à l'autre. Prenez les troubles du spectre autistique (TSA). Les causes sont encore mal comprises, mais les infections chez une mère pendant la grossesse semblent augmenter le risque de TSA chez son enfant, selon des études épidémiologiques. Par exemple, dans une cohorte suédoise de près de 1,8 million de personnes, celles dont la mère avait été hospitalisée pour une infection quelconque pendant la grossesse avaient 79 % plus de risques de se voir diagnostiquer un TSA 9.
Les recherches menées sur les souris confirment également ce lien. Pour imiter une infection, les chercheurs injectent à des souris enceintes de l'ARN double brin, que le corps considère comme un envahisseur viral. Leurs petits présentent plus de comportements répétitifs et d'anxiété que ceux nés de mères qui n'ont pas reçu d'injection, et interagissent moins avec d'autres souris - des symptômes qui reflètent ceux des personnes atteintes de TSA 10.
Gloria Choi, une neuroscientifique du Picower Institute for Learning and Memory du Massachusetts Institute of Technology à Cambridge, et son mari et collaborateur Jun Huh, un immunologiste de la Harvard Medical School à Boston, ont voulu savoir pourquoi. Ils se sont concentrés sur un type de cellule qui se défend contre les bactéries et les champignons en produisant des molécules appelées cytokines. Lorsque Choi et Huh ont imité une infection chez leurs souris, ces cellules, appelées cellules T-helper 17, sont devenues hyperactives, produisant un type particulier de cytokine appelé IL-17. Cette molécule a voyagé dans le cerveau des petits en développement, probablement à travers le placenta, puis s'est liée aux récepteurs cérébraux. Cela semblait avoir un effet profond sur les animaux : les chercheurs ont constaté que les descendants adultes présentaient une activité neuronale accrue, ce qui provoquait leurs comportements de type autiste 11.
Mais "toutes les femmes enceintes qui sont infectées ou hospitalisées pendant leur grossesse n'ont pas nécessairement des enfants atteints de troubles du développement neurologique ou d'autisme", précise M. Huh. Quelque chose doit faire pencher le système immunitaire de la mère vers cet état d'hyperactivité. Choi et Huh se sont concentrés sur une collection de microbes intestinaux longs et fins connus sous le nom de bactéries filamenteuses segmentées, dont on avait précédemment montré qu'elles favorisaient la formation de cellules T auxiliaires 17. Lorsqu'ils ont traité des souris gravides avec un antibiotique pour tuer ces bactéries et ont ensuite stimulé une réponse immunitaire, les petits n'ont pas développé de différences de comportement 12.
Choi et Huh, désireux de savoir si la pandémie de coronavirus pourrait entraîner un risque accru de TSA, recueillent des échantillons de femmes enceintes infectées par le CoV-2 du SRAS et cataloguent la bactérie dans leurs intestins et les niveaux d'IL-17 dans leur sang. Étant donné que le coronavirus, comme toute autre infection, active le système immunitaire de la mère, il est plausible que le CoV-2 du SRAS puisse augmenter le risque d'altération du développement du cerveau et de troubles psychiatriques potentiels, déclare David Amaral, qui étudie les TSA à l'université de Californie, à Davis. Les chercheurs n'ont pas encore trouvé de preuves à l'appui de cette théorie.
Mauro Costa-Mattioli, neurobiologiste au Baylor College of Medicine de Houston, au Texas, étudie également la relation entre les bactéries et les TSA. Mais plutôt que d'examiner les microbes qui causent ce trouble, il en a trouvé un qui pourrait en traiter les symptômes.
Micrographie de la bactérie Lactobacillus reuteri en forme de bâtonnet dans la couche de mucus de l'intestin grêle d'un être humain
Agrandissement : Illustration 3
Costa-Mattioli est tombé par hasard sur cette bactérie il y a environ cinq ans. À l'époque, il travaillait sur des souris dont la progéniture présentait des symptômes semblables à ceux de l'autisme. Lorsque ces souris ont été hébergées avec des neurotypes (et ont mangé leurs excréments, comme toutes les souris ont l'habitude de le faire), leurs comportements de type TSA ont disparu. M. Costa-Mattioli et ses collègues ont découvert qu'il manquait une espèce particulière de bactérie aux souris concernées : Lactobacillus reuteri.
Ils ont testé L. reuteri sur plusieurs autres modèles de souris, et la bactérie a pu inverser certains des comportements de type TSA chez chacune d'entre elles. Et, tout comme pour les travaux sur la maladie de Parkinson, les chercheurs ont pu bloquer l'effet chez les souris si elles sectionnaient le nerf vague 13.
On ne sait pas encore exactement quel type de signal L. reuteri envoie. L'équipe a découvert que certaines souches de L. reuteri peuvent inverser les comportements tandis que d'autres ne le peuvent pas, et les chercheurs s'efforcent maintenant de découvrir lesquels de ses gènes sont impliqués. S'ils trouvent le gène qui produit un métabolite clé, "nous pourrons le mettre dans n'importe quelle bactérie et nous aurons peut-être alors un traitement potentiel", explique Costa-Mattioli. Cette stratégie doit encore être testée.
Un groupe en Italie essaie déjà le L. reuteri comme thérapie chez 80 enfants atteints de TSA. Les participants prendront L. reuteri ou un comprimé placebo pendant six mois, et feront l'objet d'un suivi de leurs symptômes. Costa-Mattioli espère lancer bientôt son propre essai.
Il reste à voir si cela fonctionnera, mais Kevin Mitchell, un neurogénéticien du Trinity College de Dublin, ne trouve pas encore les études sur les souris convaincantes. Et il considère que la discussion sur le potentiel thérapeutique est prématurée et "un peu irresponsable", dit-il, étant donné la complexité de la condition.
En attendant, les chercheurs explorent d'autres maladies du cerveau, dont la maladie d'Alzheimer et la dépression. Les microbes intestinaux pourraient même influencer la façon dont le cerveau se remet d'une blessure. Corinne Benakis, neurobiologiste à l'Institut de recherche sur les accidents vasculaires cérébraux et la démence de l'Université Ludwig Maximilians de Munich en Allemagne, et ses collègues ont traité des souris avec des antibiotiques pour éliminer certaines bactéries de leur intestin avant de provoquer un accident vasculaire cérébral. Ils ont découvert que les antibiotiques pouvaient réduire la gravité des lésions cérébrales 14.
Dans chacune de ces maladies, de nombreuses questions d'ordre mécanique demeurent. Les chercheurs dans ce domaine reconnaissent qu'ils n'ont pas encore précisé les voies de transmission du microbe au cerveau. Et l'étape la plus délicate consistera à valider ces découvertes animales chez l'homme et à passer à l'étape des essais. "Ce sont des affirmations extraordinaires, qui devraient nécessiter des preuves extraordinaires", déclare M. Mitchell.
Mais il y a aussi un intérêt énorme - et pas seulement de la part des universitaires. En février 2019, Axial Therapeutics à Waltham, Massachusetts, une société co-fondée par Mazmanian pour développer des thérapies pour les maladies neurodégénératives et neuropsychiatriques, a levé 25 millions de dollars de financement. Une autre société, Finch Therapeutics à Somerville, Massachusetts, qui développe un médicament à base de microbiome oral pour les TSA, a annoncé en septembre qu'elle avait levé 90 millions de dollars.
Cryan a regardé les données s'accumuler depuis que son exposé sur le sujet a été accueilli par un silence de plomb. Il trouve les preuves de plus en plus convaincantes et voit d'énormes promesses dans les thérapies basées sur le microbiome. "Contrairement à votre génome, sur lequel vous ne pouvez pas faire grand-chose si ce n'est de blâmer vos parents et grands-parents, votre microbiome est potentiellement modifiable. Et cela donne une grande capacité d'action aux patients", dit-il. "C'est vraiment passionnant".
Références
- Neufeld, K. M., Kang, N., Bienenstock, J. & Foster, J. A. Neurogastroenterol. Motil. 23, 255–e119 (2011).PubMed Article Google Scholar
- Friedland, R. P. J. Alzheimer’s Dis. 45, 349–362 (2015).Article Google Scholar
- Chen, S. G. et al. Sci. Rep. 6, 34477 (2016).PubMed ArticleGoogle Scholar
- Sampson, T. R. et al. eLife 9, e53111 (2020).PubMed Article Google Scholar
- Svensson, E. et al. Ann. Neurol. 78, 522–529 (2015). PubMed Article Google Scholar
- Kim, S. et al. Neuron 103, 627–641 (2019). PubMed Article Google Scholar
- Blacher, E. et al. Nature 572, 474–480 (2019).PubMed Article Google Scholar
- de la Rubia, J. E. et al. Amyotroph. Lateral Scler. Frontotemp. Degen. 20, 115–122 (2019).Article Google Scholar
- al-Haddad, B. J. S. et al. JAMA Psychiatry 76, 594–602 (2019).PubMed Article Google Scholar
- Careaga, M., Murai, T. & Bauman, M. D. Biol. Psychiatry 81, 391–401 (2017).pubMed Article Google Scholar
- Yim, Y. S. et al. Nature 549, 482–487 (2017). PubMed Article Google Scholar
- Kim, S. et al. Nature 549, 528–532 (2017).PubMed Article Google Scholar
- Sgritta, M. et al. Neuron 101, 246–259 (2019). PubMed Article Google Scholar
- Benakis, C. et al. Nature Med. 22, 516–523 (2016). PubMed Article Google Scholar
27 juil. 2019 - Les traitements basés sur le microbiome prolifèrent à l'initiative des familles : greffes fécales, vers, compléments alimentaires. Les chercheurs sont en retard, les preuves manquent...
Autisme - Une étude sur le microbiome déclenche une réaction rapide de contestation
28 juil. 2019 - Pas si vite : L'affirmation selon laquelle les composés microbiens peuvent soulager les comportements autistiques est prématurée, selon plusieurs critiques.
Une étude révèle des différences de microbiome chez les enfants autistes
15 janv. 2021 - Contrôle de l'intestin : L'échantillonnage répété dans les études de microbiome intestinal peut aider à contrôler les variables pouvant prêter à confusion.



